
【题目】利用活性炭还原法处理氮氧化物。有关反应为C(s)+2NO(g)![]() N2(g)+ CO2(g) △H=akJ/mol。某研究小组向某恒容密闭容器中加入一定量的活性炭和NO,恒温(T1℃)条件下反应,已知在不同时间测得各物质的浓度如下:
N2(g)+ CO2(g) △H=akJ/mol。某研究小组向某恒容密闭容器中加入一定量的活性炭和NO,恒温(T1℃)条件下反应,已知在不同时间测得各物质的浓度如下:
| 0 | 10 | 20 | 30 | 40 | 50 |
NO | 0.100 | 0.076 | 0.060 | 0.060 | 0.050 | 0.050 |
N2 | 0 | 0.012 | 0.020 | 0.020 | 0.025 | 0.025 |
CO2 | 0 | 0.012 | 0.020 | 0.020 | 0.011 | 0.011 |
(1
(2)30s后,改变某一条件,反应重新达到平衡,则改变的条件可能是________,若30s后升高温度至T2℃,平衡时,容器中NO的浓度由0.060mol/L变为0.072mol/L,则该反应的a___0 (填“>”、“<”或“=”)。
科目:高中化学 来源: 题型:
【题目】化合物H(4-苯基-2-丁酮)是一种重要的医药中间体。以下是合成H的一种路线:
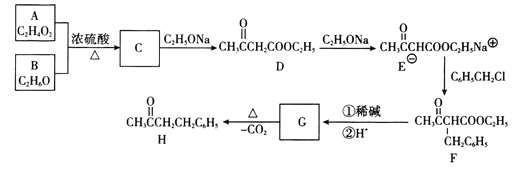
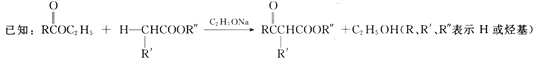
回答下列问题:
(1)A的化学名称为__________________。
(2)D中官能团的名称为___________,E→F的化学反应类型为___________________。
(3)G的结构简式为________________________。
(4)写出C→D的化学反应方程式:__________________________________________。
(5)H存在多种同分异构体,满足下列条件的同分异构体共___________种,其中核磁共振氢谱有5组峰,峰面积比为6:2:2:1:1的结构简式为__________________________。
①含有苯环且只有一个支链;②能发生银镜反应
(6)结合信息,写出用乙酸乙酯为原料制备化合物丙酮(CH3COCH3)的合成路线:___________________________________________________________(其他试剂任选)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇是重要的化工原料。利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,可能发生的反应如下:
i. CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g) △H1
CH3OH(g)+H2O(g) △H1
ii. CO2(g)+ H2(g)![]() CO(g)+H2O(g) △H2
CO(g)+H2O(g) △H2
iii. CH3OH(g)![]() CO(g) +2H2(g) △H3
CO(g) +2H2(g) △H3
回答下列问题:
(1)已知反应ⅱ中相关化学键键能数据如下:

由此计算△H2=__________kJ·mol-1。已知△H3=99kJ·mol-1,则△H1=_________kJ·mol-1。
(2)一定比例的合成气在装有催化剂的反应器中反应12小时。体系中甲醇的产率和催化剂的催化活性与温度的关系如图1所示。

①温度为470K时,图中P点_______ (填“是”或“不是”)处于平衡状态。在490K之前,甲醇产率随着温度升高而增大的原因是_______;490K之后,甲醇产率下降的原因是_______。
②一定能提高甲醇产率的措施是______________。
A.增大压强 B,升高温度 C.选择合适催化剂 D.加入大量催化剂
(3)图2为一定比例的CO2/H2,CO/H2、CO/CO2/H2条件下甲醇生成速率与温度的关系。
①490K时,根据曲线a、c判断合成甲醇的反应机理是_________ (填“I”或“II")。
![]()
②490K时,曲线a与曲线b相比,CO的存在使甲醇生成速率增大,从热力学与动力学角度,并结合反应i、ⅱ分析原因_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,某容积固定的密闭容器由可移动的活塞隔成左、右两室,左室充入等物质的量的氢气和氧气,右室充入一氧化碳和氧气的混合气。同时引燃左右两室的混合气,反应后恢复到室温。反应前后活塞位置如下图所示,则右室混合气体中一氧化碳和氧气的物质的量之比可能是(液态水的体积忽略不计)

①1:1 ②1:2 ③1:3 ④3:1
A. ①② B. ②④ C. ①④ D. ①③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)标准状况下,3.4gNH3与________LCO气体所含有电子数相同。
(2)0.2L0.5mol·L-1Al2(SO4)3溶液和0.5L0.5mol·L-1Na2SO4溶液,所含SO42-离子浓度之比为_________。
(3)标准状况下,NH3 与 CH4 组成的混合气体的平均密度为 0.75g/L,则 NH3 的体积分数为__________
(4)配制 100mL 2mol/L 的 H2SO4 溶液,取配制后的溶液 20mL,加入足量的锌,生成标况下 氢气的体积为_____L。
(5)已知 16g A 和 20g B 恰好完全反应生成 0.04mol C 和 32g D,则 C 的摩尔质量为______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四碘化锡(SnI4)是一种橙红色固体,熔点为144.5℃,沸点为364℃,易水解,易溶于有机溶剂,实验室通过如图所示装置用锡和碘单质制备SnI4,实验步骤如下:
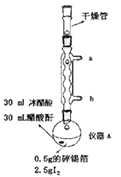
一、洗涤并干燥仪器,然后按照图中标注用量向仪器A中加入各种药品并组装仪器。
二、通入冷凝水,加热仪器A至装置中紫色蒸气消失,溶液颜色由紫红色变为橙红色。
三、停止加热,趁热过滤除去固体杂质,将滤液在烧杯中冷却析出晶体。
四、对所得晶体进行重结晶,过滤、洗涤、干燥、称量。
请回答下列相关问题:
(1)仪器A的名称是__________________,装置中球形冷凝管的作用是__________________,其效果优于直形冷凝管的原因是__________________。
(2)从实验步骤及装置图分析,实验过程中主要目的是防止SnI4水解的操作有___________、_______。
(3)若最终所得晶体的质量为2.2g,则锡的转化率为_______________(保留三位有效数字)。
(4)SnI4遇水发生复分解反应生成一种白色沉淀和一种强酸,检验反应后所得的溶液中的阴离子的常用方法有以下三种,请补充其中所缺试剂。
①沉淀法:稀硝酸和________________;②置换--萃取法;新制氯水和__________________;③利用该元素对应单质的某种特征反应:新制氯水和____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解装置如图所示,电解槽内装有 KI 及淀粉溶液,中间用阴离子交换膜 隔开.在一定的电压下通电,发现左侧溶液变蓝色,一段时间后,蓝色逐渐变 浅。已知:3I2+6OH﹣=IO3﹣+5I﹣+3H2O,下列说法不正确的是( )
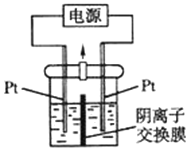
A. 右侧发生的电极反应式:2H2O+2e﹣=H2↑+2OH﹣
B. 电解结束后,右侧溶液中含有 IO3﹣
C. 电解槽内发生反应的总化学方程式:KI+3H2O![]() KIO3+3H2↑
KIO3+3H2↑
D. 如果用阳离子交换膜代替阴离子交换膜,电解槽内发生的总化学方程式不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为维持人体血液中的血糖含量,在给病人输液时,通常用葡萄糖注射液。右图是医院病人输液使用的一瓶质量分数为5%的葡萄糖(C6H12O6)注射液标签,请认真观察标签上所列内容后列式计算(要求写出计算过程):

(1)该溶液的物质的量浓度为_________ mol·L-1(结果保留2位有效数字);
(2)该溶液的密度为__________ g·mL-1;
(3)如果从该瓶中取出75g葡萄糖注射液,将其变为15%的注射液,需要加入______g葡萄糖固体(质量精确到0.1g)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com