
| A. | 分子中所有原子共平面 | B. | 碳氧原子之间含有1个α键和1个π键 | ||
| C. | 分子中既含单键又含双键 | D. | 分子中既含极性键又含非极性键 |
分析 A.中心C原子采用sp2杂化成键,分子为平面三角形;
B.分子中存在C=O键;
C.分子中存在C=O和C-Cl键;
D.同种非金属原子之间形成非极性键,不同非金属原子之间形成极性键.
解答 解:A.中心C原子采用sp2杂化成键,分子为平面三角形,所以分子中所有原子共平面,故A正确;
B.分子中存在C=O键,双键中含有1个α键和1个π键,故B正确;
C.分子中存在C=O和C-Cl键,即分子中既含单键又含双键,故C正确;
D.同种非金属原子之间形成非极性键,不同非金属原子之间形成极性键,则COCl2中只存在极性键,故D错误.
故选D.
点评 本题考查了分子的构型、共价键的类型等,题目难度不大,侧重于基础知识的考查,注意把握共价键的分类.


科目:高中化学 来源: 题型:选择题
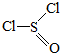 )主要用于制造酰基氯化物,其工业制备原理:
)主要用于制造酰基氯化物,其工业制备原理:| A. | SCl2和SOCl2中S的化合价分别为+2、+4价 | |
| B. | 制备反应中,二氧化硫是氧化产物 | |
| C. | 每消耗1mol SCl2,转移1mol电子 | |
| D. | SOCl2分子中既含有离子键又含有共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
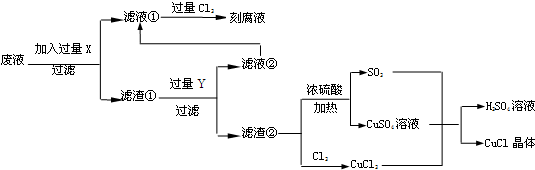
| 1 | 2 | 3 | |
| 0.25克样品消耗硫酸铈标准溶液的体积(mL) | 23.85 | 24.35 | 23.95 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X的氢化物的水溶液呈酸性 | |
| B. | Y的氧化物和氢氧化物均不溶于水 | |
| C. | Z的最高价含氧酸的浓溶液有强氧化性 | |
| D. | W原子半径在同周期中最小 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
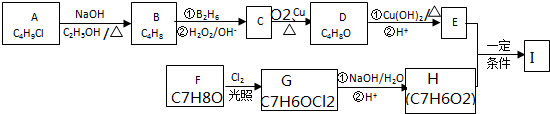

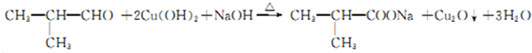 .
. .
.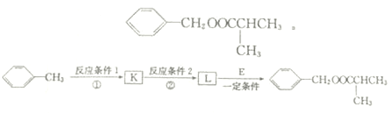 反应②所选用的试剂为氢氧化钠溶液,L的结构简式为
反应②所选用的试剂为氢氧化钠溶液,L的结构简式为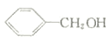 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
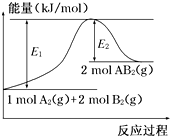 已知某化学反应A2(g)+2B2(g)═2AB2(g)(AB2的分子结构为B-A-B)的能量变化如图所示,下列有关叙述中正确的是( )
已知某化学反应A2(g)+2B2(g)═2AB2(g)(AB2的分子结构为B-A-B)的能量变化如图所示,下列有关叙述中正确的是( )| A. | 该反应的进行一定需要加热 | |
| B. | 该反应的△H=-(E1-E2)kJ/mol | |
| C. | 该反应中反应物的键能总和大于生成物的键能总和 | |
| D. | 断裂1 mol A-A和2 mol B-B放出E1 kJ能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com