
【题目】环氧乙烷常用于一次性口罩生产过程中灭菌和新冠病毒的消杀,工业上常利用乙烯直接氧化法生产环氧乙烷(![]() ),发生的反应如下。
),发生的反应如下。
主反应Ⅰ:2CH2=CH2(g)+O2(g)![]() 2
2![]() (g) ΔH1=-210kJ·mol-1
(g) ΔH1=-210kJ·mol-1
副反应Ⅱ:CH2=CH2(g)+3O2(g)![]() 2CO2(g)+2H2O(l) ΔH2=-1324kJ·mol-1
2CO2(g)+2H2O(l) ΔH2=-1324kJ·mol-1
副反应Ⅲ:2![]() (g)+5O2(g)
(g)+5O2(g)![]() 4CO2(g)+4H2O(g) ΔH3
4CO2(g)+4H2O(g) ΔH3
已知:环氧乙烷选择性是指乙烯进行反应Ⅰ生成环氧乙烷的优势。
(1)ΔH3=__kJ·mol-1。
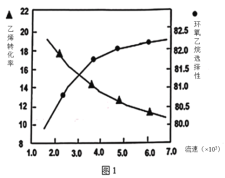
(2)①图1是乙烯转化率、环氧乙烷选择性与流速关系的图象,图中随进料气的流速加快,乙烯的转化率下降,其可能原因是__。
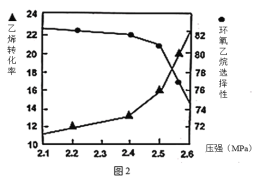
②图2是乙烯转化率、环氧乙烷选择性与压强关系的图象,图中当反应体系的压强高于2.4MPa,环氧乙烷选择性下降,其可能原因是__。
(3)实验测得反应Ⅰ中,υ正=K正·x2(CH2=CH2)·x(O2),υ逆=K逆·x2(![]() ),(式中x为物质的量分数;K正、K逆为速率常数,只与温度有关)。
),(式中x为物质的量分数;K正、K逆为速率常数,只与温度有关)。
①若在1L的密闭容器中充2molCH2=CH2(g)和1molO2(g),在一定温度下只发生反应I,达到平衡时CH2=CH2的转化率为75%,则该反应平衡常数的值为__。
②若平衡后仅升高温度,则下列说法正确的是___。
A.x(CH2=CH2)增大,x(![]() )减小
)减小
B.K正与K逆的比值增大
C.υ正减小,υ逆增大
D.K正与K逆的比值减小
(4)将乙烯与饱和食盐水的电解产物反应,转化为氯乙醇[CH2(OH)CH2Cl],氯乙醇进一步反应生成环氧乙烷,其电解简易装置如图所示。
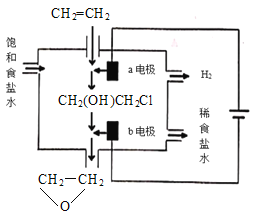
已知:CH2=CH2+H2O+Cl2→CH2(OH)CH2Cl+HCl
①a电极为__(选填“阴极”或“阳极”),其电极反应式为:__。
②b电极区域生成环氧乙烷的化学方程式为__。
【答案】-2438 流速越快,反应物接触时间越短,原料气与催化剂接触时间短,原料利用率低,导致乙烯转化率下降 压强增大,主、副反应速率增加,副反应Ⅱ速率可能比主反应速率增大得快,使环氧乙烷的选择性降低;压强增大,副反应Ⅲ的平衡逆移,环氧乙烷浓度增大,不利于反应Ⅰ正向进行,故环氧乙烷选择性降低 36 AD 阳极 2Cl--2e-=Cl2 CH2(OH)CH2Cl+NaOH→![]() +NaCl+H2O
+NaCl+H2O
【解析】
(1)主反应Ⅰ:①2CH2=CH2(g)+O2(g)![]() 2
2![]() (g) ΔH1=-210kJ·mol-1
(g) ΔH1=-210kJ·mol-1
副反应Ⅱ:②CH2=CH2(g)+3O2(g)![]() 2CO2(g)+2H2O(l) ΔH2=-1324kJ·mol-1
2CO2(g)+2H2O(l) ΔH2=-1324kJ·mol-1
副反应Ⅲ:③2![]() (g)+5O2(g)
(g)+5O2(g)![]() 4CO2(g)+4H2O(g) ΔH3
4CO2(g)+4H2O(g) ΔH3
根据盖斯定律,将②×2-①得反应③2![]() (g)+5O2(g)
(g)+5O2(g)![]() 4CO2(g)+4H2O(g) ΔH3=-2438kJ·mol-1。故答案为:-2438;
4CO2(g)+4H2O(g) ΔH3=-2438kJ·mol-1。故答案为:-2438;
(2)①图1随进料气的流速加快,乙烯的转化率下降,其可能原因是流速越快,反应物接触时间越短,原料气与催化剂接触时间短,原料利用率低,导致乙烯转化率下降。故答案为:流速越快,反应物接触时间越短,原料气与催化剂接触时间短,原料利用率低,导致乙烯转化率下降;
②图2当反应体系的压强高于2.4MPa,环氧乙烷选择性下降,其可能原因是压强增大,主、副反应速率增加,副反应Ⅱ速率可能比主反应速率增大得快,使环氧乙烷的选择性降低;压强增大,副反应Ⅲ的平衡逆移,环氧乙烷浓度增大,不利于反应Ⅰ正向进行,故环氧乙烷选择性降低。故答案为:压强增大,主、副反应速率增加,副反应Ⅱ速率可能比主反应速率增大得快,使环氧乙烷的选择性降低;压强增大,副反应Ⅲ的平衡逆移,环氧乙烷浓度增大,不利于反应Ⅰ正向进行,故环氧乙烷选择性降低;
(3)①若在1L的密闭容器中充2molCH2=CH2(g)和1molO2(g),在一定温度下只发生反应I,达到平衡时CH2=CH2的转化率为75%,

平衡时乙烯、氧气、环氧乙烷物质的浓度分别是:0.5mol·L-1、0.25mol·L-1、1.5mol·L-1,![]() =36,则该反应平衡常数的值为36。故答案为:36;
=36,则该反应平衡常数的值为36。故答案为:36;
②A.反应是放热反应,升高温度,平衡逆向移动,x(CH2=CH2)增大,x(![]() )减小,故A正确;
)减小,故A正确;
B.υ正=K正·x2(CH2=CH2)·x(O2),υ逆=K逆·x2(![]() ),达到平衡时υ正=υ逆,则
),达到平衡时υ正=υ逆,则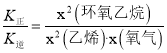 ,升高温度,正、逆反应速率都增大,逆反应速率增大的倍数大于正反应速率增大的倍数,则K正与K逆的比值减小,故B错误;
,升高温度,正、逆反应速率都增大,逆反应速率增大的倍数大于正反应速率增大的倍数,则K正与K逆的比值减小,故B错误;
C.升高温度,υ正增大,υ逆增大,故C错误;
D.由B项分析知,K正与K逆的比值减小,故D正确;
故选AD;
(4)①a连接电源正极,a电极为阳极,发生氧化反应生成氯气,其电极反应式为:2Cl--2e-=Cl2。故答案为:阳极;2Cl--2e-=Cl2;
②b为阴极,生成NaOH,CH2(OH)CH2Cl与氢氧化钠溶液反应生成环氧丙烷和NaCl,b电极区域生成环氧乙烷的化学方程式为CH2(OH)CH2Cl+NaOH→![]() +NaCl+H2O;故答案为:CH2(OH)CH2Cl+NaOH→
+NaCl+H2O;故答案为:CH2(OH)CH2Cl+NaOH→![]() +NaCl+H2O。
+NaCl+H2O。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】钼及其化合物正越来越多的受到人们的关注 ,其中钼酸钠(Na2MoO4)可溶于水,是一种重要的金属缓蚀剂;钼酸钙(CaMoO4)微溶于水,常用作钼合金添加剂;钼酸属于弱酸,微溶于水,常用于制取高纯同多酸盐。工业上利用辉钼矿(主要成分为MoS2)制备金属钼和钼酸钠晶体的流程如图所示。
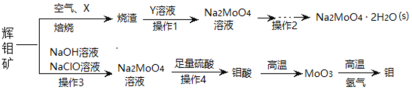
回答下列问题:
(1)辉钼矿在空气中焙烧时,加入X是为了减少空气污染,焙烧后Mo元素以CaMoO4存在,则X是________;焙烧时发生反应的化学方程式为__________。
(2)已知25℃时,钼酸钙的Ksp=1.6×10-5,则钼酸钙在该温度下的溶解度为_______g/100g水,但钼酸钙实际溶解度比计算值大许多,其原因是_______,操作2中得到的钼酸钠晶体中常混有Y,进一步提纯钼酸钠晶体的方法为__________。
(3)辉钼矿中MoS2含量测定:取辉钼矿0.2500g,经在空气中焙烧、操作1、操作2得到钼酸钠晶体0.1210g(Mr=242g/mol),辉钼矿中MoS2的质量分数不低于______%。
(4)操作3发生反应的离子方程式为_________________。
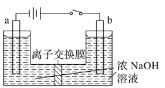
(5)用镍、钼作电极电解浓NaOH溶液制备钼酸钠(Na2MoO4)的装置如下图所示。b电极的材料为______(填“镍”或“钼”),电极反应为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】W、X、Y、Z均为短周期元素且原子序数依次增大,它们的原子最外层电子数为互不相等的奇数,Y与W形成的阴离子(如图所示)中W不满足8电子稳定结构,W与Z的最高价之和为8。下列说法中错误的是
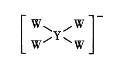
A.原子半径:Y>X>W
B.Z2O是某种弱酸的酸酐
C.W与X形成的二元化合物只能含极性键
D.最高价氧化物对应水化物的酸性:Z>X
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实能用勒夏特列原理解释的是
A.加入催化剂有利于合成氨的反应
B.由 H2(g)、I2(g)和 HI(g)组成的平衡体系加压后颜色变深
C.500 ℃时比室温更有利于合成氨的反应
D.光照新制的氯水时,溶液的 pH 逐渐减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某铜钴矿石主要含有CoO(OH)、CoCO3、Cu2(OH)2CO3和SiO2,及一定量的Fe2O3、MgO和CaO等。由该矿石制Co2O3的部分工艺流程如图:
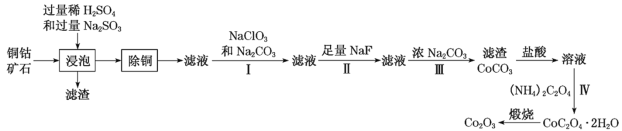
回答下列问题:
(1)“浸泡”过程中,钴(III)可转化为CoSO4,写出该转化的相关化学方程式:__。
(2)“除铜”若选用MnS,计算常温下该“除铜”反应的平衡常数K=__。[保留2位有效数字;已知常温下Ksp(MnS)=2.5×10–13,Ksp(CuS)=1.3×10–36]
(3)①步骤I中加入NaClO3与Fe2+反应的离子方程式为__。
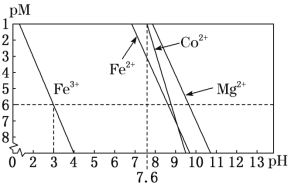
②常温下,溶液中金属离子(Mn+)的pM[pM=–lgc(Mn+)]随溶液pH变化关系如图所示,设加入NaClO3后,溶液中的c(Co2+)为0.1molL-1,依据如图分析,步骤I中加入Na2CO3调整溶液pH范围为__。[当c(Mn+)≤10–6molL–1,即认为该金属离子沉淀完全]
(4)步骤II中加入足量NaF的目的是__。
(5)过滤出的CoC2O42H2O固体经洗涤后,证明固体已洗净的操作为__。
(6)若某工厂用m1kg该铜钴矿石制备了m2kgCo2O3,假设产率为a,则该矿石中钴元素的百分含量为__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为反应2H2 (g)+O2(g)=2H2O(g)的能量变化示意图。下列说法正确的是( )
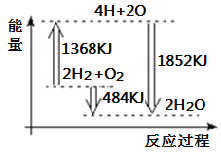
A. 由H、O原子形成2mol H2O(g),共吸收1852 kJ能量
B. 拆开2molH2 (g)和1mol O2 (g)中的化学键成为H、O原子,共放出1368kJ能量
C. 2molH2 (g)和1molO2 (g)反应生成2mol H2O(g),共放出484 kJ能量
D. 2molH2 (g)和1molO2 (g)反应生成2molH2O(l),共吸收484 kJ能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于可逆反应N2(g)+3H2(g)![]() 2NH3(g)ΔH<0,下列研究目的和示意图相符的是
2NH3(g)ΔH<0,下列研究目的和示意图相符的是
A | B | C | D | |
研究目的 | 压强对反应的影响P2>P1 | 温度对反应的影响 | 平衡体系增加氮气对反应的影响 | 催化剂对反应的影响 |
图示 |
|
|
|
|
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物的结构简式如下:
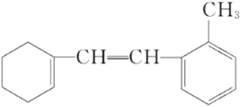
(1)该物质苯环上一氯代物有____________________种;
(2)1 mol该物质和溴水混合,消耗Br2的物质的量为____________________mol;
(3)1 mol该物质和H2加成最多需H2____________________mol;
(4)下列说法不正确的是____________________。
A.此物质可发生加成、取代、氧化等反应 |
B.该物质易溶于水 |
C.该物质能使溴水褪色 |
D.该物质能使酸性KMnO4溶液褪色 |
E.分子式是C15H18
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.核外电子的排布应优先排布在能量最低的电子层
B.对于主族元素而言,若最外层电子数为m,电子层数为n,则![]() 值越大,金属性越强
值越大,金属性越强
C.同一周期中,随着核电荷数的增加,阴离子半径逐渐增大
D.第三、四周期中,同族元素原子的核电荷数相差一定为8
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com