
| A、c(Ba2+)>c(OH-)>c(Na+)>c(SO42-) |
| B、c(Na+)>c(OH-)>c(Ba2+)>c(SO42-) |
| C、c(Na+)>c(Ba2+)>c(OH-)>c(SO42-) |
| D、c(OH-)>c(Ba2+)>c(Na+)>c(SO42-) |


 活力试卷系列答案
活力试卷系列答案 课课优能力培优100分系列答案
课课优能力培优100分系列答案科目:高中化学 来源: 题型:
| A、Na2O |
| B、Na2O2 |
| C、Na2O和Na2O2 |
| D、Na2O2和NaO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
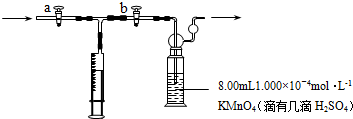
查看答案和解析>>
科目:高中化学 来源: 题型:
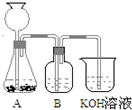 KOH是一种重要的化工原料,广泛应用于K2CO3的生产.某研究性学习小组设计了两套实验方案进行实验:
KOH是一种重要的化工原料,广泛应用于K2CO3的生产.某研究性学习小组设计了两套实验方案进行实验:查看答案和解析>>
科目:高中化学 来源: 题型:
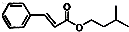 )的路线如下:
)的路线如下: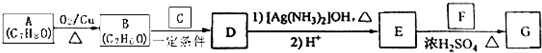
| 一定条件 |
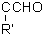 +H2O.
+H2O.查看答案和解析>>
科目:高中化学 来源: 题型:
A、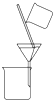 不可除去乙醇中的苯酚 |
B、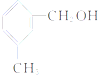 遇FeCl3溶液可显紫色 |
| C、苯酚钠溶液中通入少量二氧化碳生成碳酸钠 |
D、苯酚与Na2CO3溶液反应的离子方程式为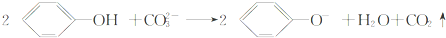 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com