
【题目】下列物质的类别与所含官能团都错误的是
A. ![]() 酚类 –OHB.
酚类 –OHB. 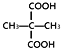 羧酸 –COOH
羧酸 –COOH
C. ![]() 醛类 –COHD. CH3-O-CH3 醚类
醛类 –COHD. CH3-O-CH3 醚类 ![]()
【答案】C
【解析】
A. 醇类是指分子中含有跟烃基或苯环侧链上的碳结合的羟基的化合物,而羟基直接连接苯环上所构成的有机物属于酚类;
B. 由烃基和羧基相连构成的有机化合物称为羧酸;
C. 醛类是含有端醛基(-CHO)的有机物,酯基是含-COO-R(R不为H)的有机物;
D. 水分子中的两个氢原子均被烃基取代的化合物称为醚,醚类化合物都含有醚键。
A. 羟基连在链烃基上的有机物属于醇类,物质的类别错误,其官能团化学式正确,故A项不选;
B. 含有羧基的物质属于羧酸,其羧基的结构简式为:-COOH,故B项不选;
C. 该物质属于酯类,称为甲酸某酯,含有醛基和酯基两个官能团,物质的类别与所含官能团均错误,故C项选;
D. 该有机物具有醚基,该有机物属于醚类,故D项不选。
答案选C。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】如图是工业上从海水中提取Mg的流程,下列说法正确的是

A.①反应的离子方程式是Mg2++2OH-=Mg(OH)2↓
B.②的实验操作不可以是蒸发浓缩、冷却结晶、过滤
C.工业上不会用电解熔融氧化镁制镁
D.MgCl26H2O可以直接加热得无水氯化镁
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】云南省曲靖的铬渣污染经媒体报道后,铬污染再次引起人们的关注。利用化学原理可以对工厂排放的含铬废水、铬渣等进行有效处理。
Ⅰ.含铬废水的处理:某企业排放的含铬废水中含有较多毒性较大的Cr2O![]() ,某研究性学习小组为了变废为宝,将废水处理得到金属铬,设计了如下的工艺流程。
,某研究性学习小组为了变废为宝,将废水处理得到金属铬,设计了如下的工艺流程。

(1)请写出通入SO2时发生的离子反应:______________________________________。
(2)写出加入铝粒时发生反应的化学方程式____________________________________。
Ⅱ.铬渣的处理
铬渣烧结炼铁法:铬渣中约含有55%的氧化钙和氧化镁,此外还含有15%左右的氧化铁,这些都是炼铁所需的成分。少量的铬渣代替消石灰同铁矿粉、煤粉混合,经烧结后送入高炉冶炼,六价铬还原为三价铬或金属铬,金属铬熔入铁水,而其他成分熔入熔渣。炼铁可使铬渣彻底解毒并充分利用,是铬渣治理的良好方法之一。
碱性溶液还原法:直接在碱性铬渣中加入硫化钠等进行六价铬的还原反应,形成Cr(OH)3沉淀后,过滤回收铬污泥。
(3)铬渣烧结炼铁法中煤粉的作用是____________。(写两点)
(4)请配平碱性溶液还原法中发生的离子反应:_______________
![]() Cr2O72-+
Cr2O72-+![]() S2-+
S2-+![]() H2O===
H2O===![]() Cr(OH)3↓+
Cr(OH)3↓+![]() S2O32-+
S2O32-+![]() OH-
OH-
(5)用足量的CO还原14 g铁的氧化物的混合物,将生成的气体通入足量的澄清石灰水中,生成沉淀25 g,则这种混合物可能是________(填序号);
①FeO、Fe2O3 ②FeO、Fe3O4 ③Fe2O3、Fe3O4
在这些混合物中,各成分的物质的量之比是________。
Ⅲ.电解法处理
工业上处理含Cr2O72-离子的酸性废水,采用以下处理方法。①往工业废水中加入适量的食盐(1~2 g·L-1),搅拌均匀;②用Fe为电极进行电解;③鼓入空气,经过一段时间后,使废水中的含铬(有毒)量降到可排放的标准。其原理是:①将Cr2O![]() 离子还原为可溶性三价铬离子;②要在电解除铬过程中,使溶液的pH不断升高,使工业废水由酸性变为碱性,再把三价铬离子变为不溶性氢氧化物除去。
离子还原为可溶性三价铬离子;②要在电解除铬过程中,使溶液的pH不断升高,使工业废水由酸性变为碱性,再把三价铬离子变为不溶性氢氧化物除去。
(6)加入食盐的目的是______________________________________________________;电解时阳极反应式为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2017年3月21日是第二十五届“世界水日”,保护水资源,合理利用废水节省水资源,加强废水的回收利用已被越来越多的人所关注。已知:某无色废水中可能含有H+、NH4+、Fe3+、Al3+、Mg2+、Na+、NO3-、CO32-、SO42-中的几种,为分析其成分,分别取废水样品1L,进行了三组实验,其操作和有关图像如下所示:
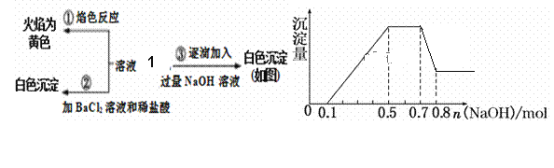
请回答下列问题:
(1)根据上述3组实验可以分析废水中一定不存在的阴离子是__________,一定存在的阳离子是___________。
(2)写出实验③图像中沉淀达到最大量且质量不再发生变化阶段发生反应的离子反应方程式:________。
(3)分析图像,在原溶液中c(NH4+)与c(Al3+)的比值为______,所得沉淀的最大质量是______g。
(4)若通过实验确定原废水中c(Na+)=0.18 mol·L-1,试判断原废水中NO3-是否存在?____(填“存在”“不存在”或“不确定”)。若存在, c(NO3-) = _____ mol·L-1。(若不存在或不确定则此空不填)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将标准状况下6.72L HCl溶于水配成100mL溶液,现用此盐酸与19.5g 锌粒反应制取氢气。试计算:(写出计算过程)
(1)此盐酸的物质的量浓度________________
(2)若要使锌完全反应,则所需盐酸的最小体积______________
(3)当锌粒完全反应时,制得标准状况下氢气的体积___________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三位分别来自法国、美国、荷兰的科学家因研究“分子机器的设计与合成”而获得2016年诺贝尔化学奖。纳米分子机器日益受到关注,机器的“车轮”常用组件如下,下列说法正确的是



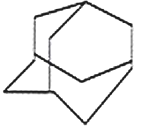
①(三碟烯) ②(扭曲烷) ③(富勒烯) ④(金刚烷)
A. ①③均能发生加成反应B. ①④互为同分异构体
C. 只有②③④属于烃D. ①②③④的一氯代物均只有一种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏加德罗常数,下列说法正确的是( )
A.将1L0.1mol/L的FeCl3溶液制成胶体后,其中含有氢氧化铁胶粒数为0.1NA
B.常温常压下,23gNO2和N2O4的混合气体一定含有NA个氧原子
C.1L0.1mol/L Na2SO4溶液中含有0.4NA个氧原子
D.在标准状况下,22.4L的CCl4所含的分子数为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】烧杯中盛有100 mL1mol/L的NaHSO4溶液,向其中逐滴滴加1mol/L的Ba(OH)2溶液,烧杯中某些物质(或微粒)的物质的量的变化曲线如图。下列说法中正确的是( )

A.曲线d表示Na+的物质的量的变化
B.曲线c表示OH-的物质的量的变化
C.加入Ba(OH)2溶液50 mL反应的离子方程式为:Ba2++OH-+H++SO42-=BaSO4↓+H2O
D.加入Ba(OH)2溶液大于50mL后,反应的离子方程式为:OH-+H+=H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有21.6g由CO和CO2组成的混合气体,在标准状况下其体积为13.44L。回答下列问题:
(1)该混合气体CO和CO2的物质的量之比为___,平均摩尔质量为___。
(2)将混合气体依次通过如图所示装置,最后收集在气球中(实验在标准状况下测定)。

①气球中收集到的气体的摩尔质量为___。
②气球中收集到的气体中,电子总数为___NA。
③气球的体积为___L。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com