
【题目】【加试题】氮及其化合物在生活和生产中应用广泛。
(1)N2O是一种强大的温室气体,在一定条件下,其分解的化学方程式为:2N2O(g)=2N2(g)+O2(g) ΔH<0,你认为该反应的逆反应是否自发进行,请判断并说明理由___________。
某研究小组为针对N2O的分解进行研究,常温下,在1L恒容容器中充入0.100mol N2O气体,加热到一定温度后使之反应,请画出容器中气体的总浓度c(总)随时间t变化的总趋势图。_____________
(2)①N2O5是一种新型硝化剂。工业上可用N2O4通过电解制备N2O5,阴、阳极室之间用质子交换膜隔开,两极电解液分别为稀硝酸溶液和溶有N2O4的无水硝酸,用惰性电极电解时,生成N2O5极室的电极反应式为_____________。
②已知,一定条件下有下列反应:
Ⅰ2N2O5(g)![]() 4NO2(g)+ O2(g) ΔH1
4NO2(g)+ O2(g) ΔH1
Ⅱ2NO2(g)![]() 2NO(g)+ O2(g) ΔH2
2NO(g)+ O2(g) ΔH2
Ⅲ2NaOH(aq)+N2O5(g)=2NaNO3(aq)+H2O(1) ΔH3
写出NO和O2的混合物溶于NaOH溶液生成硝酸盐的热化学方程式___________。
在容积为2L的恒容密闭容器中充入1.00mol N2O5,假设在T℃时只发生反应Ⅰ、Ⅱ,若达到平衡状态后O2为1.00mol,NO2为0.400mol,则T℃时反应Ⅰ的平衡常数的值为_________。
(3)NH3和Cr2O3固体在高温下可以制备多功能材料CrN晶体,其反应为Cr2O3(s)+2NH3(g) ![]() 2CrN(s)+3H2O(g)。在800℃时,为降低相同时间内收集到的粗产品中氧的含量,通过提高反应器中NH3(g)流量的工艺手段达成,请解释可能的原因___________。
2CrN(s)+3H2O(g)。在800℃时,为降低相同时间内收集到的粗产品中氧的含量,通过提高反应器中NH3(g)流量的工艺手段达成,请解释可能的原因___________。
【答案】 一定不能,因为该逆反应的ΔS<0、ΔH>0,所以该逆反应不能自发 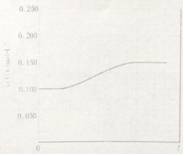 N2O4-2e-+2HNO3=2N2O5+2H+ 4NO(g)+3O2(g)+4NaOH(aq)=4NaNO3(aq)+2H2O(1) ΔH=ΔH3-ΔH1-2ΔH2 8.00×10-2 高NH3流量相当于使c(NH3)浓度增大,若反应为达平衡,反应物浓度增加反应速率加快,一定时间内Cr2O3转化率提高;若反应达到平衡,反应物浓度增加且带走H2O(g),都使平衡转移,提高Cr2O3的平衡转户率。
N2O4-2e-+2HNO3=2N2O5+2H+ 4NO(g)+3O2(g)+4NaOH(aq)=4NaNO3(aq)+2H2O(1) ΔH=ΔH3-ΔH1-2ΔH2 8.00×10-2 高NH3流量相当于使c(NH3)浓度增大,若反应为达平衡,反应物浓度增加反应速率加快,一定时间内Cr2O3转化率提高;若反应达到平衡,反应物浓度增加且带走H2O(g),都使平衡转移,提高Cr2O3的平衡转户率。
【解析】(1)根据方程式可知该逆反应的ΔS<0、ΔH>0,所以根据ΔG=ΔH-T·ΔS可知该逆反应一定不能自发。N2O的分解反应是体积增加的可逆反应,则容器中气体的总浓度c(总)随时间t变化的总趋势图为。(2)①N2O4在阳极失去电子转化为N2O5,由于电解质溶液显酸性,则用惰性电极电解时生成N2O5极室的电极反应式为N2O4-2e-+2HNO3=2N2O5+2H+。②已知:
Ⅰ2N2O5(g)![]() 4NO2(g)+ O2(g) ΔH1
4NO2(g)+ O2(g) ΔH1
Ⅱ2NO2(g)![]() 2NO(g)+ O2(g) ΔH2
2NO(g)+ O2(g) ΔH2
Ⅲ2NaOH(aq)+N2O5(g)=2NaNO3(aq)+H2O(1) ΔH3
根据盖斯定律可知Ⅲ-Ⅰ-2×Ⅱ即得到NO和O2的混合物溶于NaOH溶液生成硝酸盐的热化学方程式4NO(g)+3O2(g)+4NaOH(aq)=4NaNO3(aq)+2H2O(1) ΔH=ΔH3-ΔH1-2ΔH2。
设平衡时N2O5是xmol,消耗N2O5是(1-x)mol,反应Ⅰ中生成氧气和NO2分别是0.5×(1-x)mol、(2-2x)mol,因此参加反应Ⅱ的NO2是(2-2x)mol-0.4mol,反应Ⅱ中生成氧气是(1-x)mol-0.2mol,则(1-x)mol-0.2mol+0.5×(1-x)mol=1mol,解得x=0.2,则平衡时N2O5(g)、NO2(g)、O2(g)的浓度分别是0.1mol/L、0.2mol/L、0.5mol/L,因此T℃时反应Ⅰ的平衡常数的值为![]() =0.08。(3)高NH3流量相当于使c(NH3)浓度增大,若反应未达平衡,反应物浓度增加反应速率加快,一定时间内Cr2O3转化率提高;若反应达到平衡,反应物浓度增加且带走H2O(g),都使平衡转移,提高Cr2O3的平衡转化率。
=0.08。(3)高NH3流量相当于使c(NH3)浓度增大,若反应未达平衡,反应物浓度增加反应速率加快,一定时间内Cr2O3转化率提高;若反应达到平衡,反应物浓度增加且带走H2O(g),都使平衡转移,提高Cr2O3的平衡转化率。


科目:高中化学 来源: 题型:
【题目】【福建省宁德市2017届高三毕业班第三次质量检查化学试题】 化学与生产、生活、环境密切相关。下列有关说法正确的是
A. 酸雨的pH在5.6~7.0之间 B. 向海水中加入明矾可以使海水淡化
C. 硅太阳能电池与原电池的原理相同 D. CO2和CH4均能引起温室效应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示为阿伏加德罗常数,下列叙述中,正确的是( )
A. 常温常压下,16 gSO2所含的分子数为0.25NA
B. 46 gNO2与N2O4的混合气体中所含的分子数是1NA
C. 0.1 molCl2完全反应,转移电子数目一定为0.2NA
D. 0.1 molH2与Cl2的混合气体充分反应后,体系中含有共价键总数为0.2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列相关叙述正确的是( )
A.甲烷的燃烧热为-890.3kJ·mol-1,则甲烷燃烧的热化学方程式可表示为:
CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H=-890.3kJ·mol-1
B. 500℃、30MPa下,将0.5mol N2和 1.5molH2置于密闭的容器中充分反应生成NH3,放热19.3kJ,其热化学方程式为:N2(g) + 3H2(g)![]() 2NH3(g) ; △H=-38.6kJ·mol-1
2NH3(g) ; △H=-38.6kJ·mol-1
C. H2SO4(aq)+ 2NaOH(aq)=Na2SO4(aq)+2H2O(l) △H=-114.6 kJmol-1 为 H2SO4和 NaOH 反应的中和热对应的热反应方程式
D.由 C(石墨)=C(金刚石); △H= +1.9 kJ·mol-1 可知, 金刚石比石墨能量高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】12mL浓度为0.10molL-1的Na2SO3溶液,恰好与10mL浓度为0.04molL-1的K2Cr2O7溶液完全反应,已知Na2SO3能被K2Cr2O7氧化为Na2SO4,则元素Cr在还原产物中的化合价为
A. +5
B. +4
C. +3
D. +2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧硫化碳(COS)可作储粮杀虫剂,已知COS与CO2的结构相似,试写出COS的电子式___________,COS属于_______分子(填“极性”或“非极性”)。COS的沸点___________CO2的沸点(填“大于”或“小于”),并说出理由_________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】0.6mol锌粉跟过量盐酸反应,在一定温度下,为加快反应速率但又不影响生成氢气的总量,可向反应混合物中加入适量的( )
A.铜粉
B.醋酸锌溶液
C.氯化铜固体
D.二氧化锰
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应在任何温度下均能自发进行的是( )
A. 2N2(g)+O2(g)═2N2O(g)△H=+163kJmol1 B. Ag(s)+1/2Cl2(g)═2AgCl(s)△H=127kJmol1 C. 2HgO(s)═2Hg(l)+O2(g)△H=+91kJmol1 D. 2H2O2(l)═O2(g)+2H2O(l)△H=98kJmol1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com