
分析 (1)同分异构体是指分子式相同,但结构不同的有机化合物,而同素异形体是指由同种元素组成的不同单质;
(2)分子晶体熔化不需要破坏化学键,原子晶体熔化时需要破坏共价键,离子晶体熔化时需要破坏离子键;共价键为非金属原子之间形成的化学键,离子键为阴阳离子之间形成的化学键,根据物质的组成进行判断;
(3)根据反应中变化的物质的量之比等于化学计量数之比,求出反应的氧气的物质的量,然后根据转化率=$\frac{消耗量}{起始量}$×100%来解答;根据方程式,计算出SO3的物质的量,再利用c=$\frac{n}{V}$计算SO3的物质的量浓度.
解答 解:(1)A、正丁烷和异丁烷的分子式都是C4H10,但结构不同,则互为同分异构体;
B、金刚石、石墨和C60都是由碳元素组成的,但属于不同的单质,则互为同素异形体;
C、冰和干冰的成分分别是水、二氧化碳,是两种不同的物质;
D、35Cl和37Cl是质子数相同,中子数不同的原子,则为同种元素的不同核素,互为同位素;
E、NO和NO2是两种不同的物质;
故答案为:A;B;
(2)分子晶体熔化不需要破坏化学键,所以熔化时不需要破坏化学键的是①干冰;
②金刚石③NH4Cl④Na2S分别属于原子晶体、离子晶体、离子晶体,熔化时需要破坏共价键、离子键、离子键;
①干冰中碳氧之间形成共价键;
②金刚石中碳碳之间形成共价键;
③NH4Cl中氯离子和铵根离子之间存在离子键,铵根离子中氮原子和氢原子之间存在共价键;
④Na2S中钠离子与硫离子之间形成离子键,
故答案为:①;③;
(3)向一个容积为2L的密闭容器中充入7mol SO2和4mol O2,在一定温度和压强下,发生如下反应:2SO2(g)+O2(g)?2SO3(g),经4s后达到平衡状态,测得SO2的物质的量是3mol,则反应的SO2的物质的量是4mol,反应中变化的物质的量之比等于化学计量数之比,所以消耗的氧气的物质的量为2mol,平衡状态时O2的转化率为$\frac{2mol}{4mol}$×100%=50%;
参加反应的SO2的物质的量为7mol-3mol=4mol,根据方程式2SO2(g)+O2(g)?2SO3(g)可知,生成的SO3的物质的量等于参加反应的SO2的物质的量,平衡时SO3的物质的量浓度为c(SO3)=$\frac{4mol}{4L}$=1mol/L;
故答案为:50%;1.
点评 本题是一道拼凑题,涉及知识点多,如化学键的类型以及变化时的化学键的变化,同素异形体、同分异构体、化学反应速率以及平衡的有关计算,难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 乙烯的结构简式为:CH2CH2 | B. | H2O的电子式: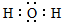 | ||
| C. | 葡萄糖的分子式:C12H22O11 | D. | 14C的原子结构示意图: |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
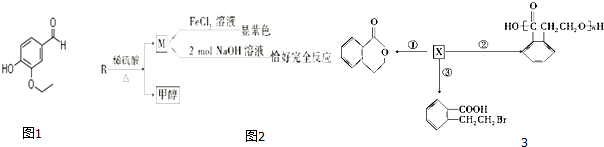
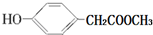 ,符合上述条件的R分子核磁共振氢谱有5组峰.
,符合上述条件的R分子核磁共振氢谱有5组峰.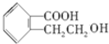 ;
; .反应②的反应类型缩聚反应.请设计合理方案,完成从
.反应②的反应类型缩聚反应.请设计合理方案,完成从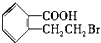 到
到 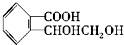 的合成路线(用合成路线流程图表示,并注明反应条件):
的合成路线(用合成路线流程图表示,并注明反应条件): .
.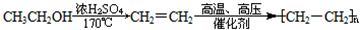
查看答案和解析>>
科目:高中化学 来源: 题型:推断题

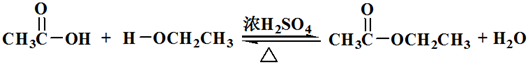 .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题

 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 200mL | B. | 500 mL | C. | 250 mL | D. | 100 mL |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 调味剂和着色剂是食品添加剂,添加量越多越好 | |
| B. | 蔬菜、水果富含膳食纤维,适量摄入有利人体健康 | |
| C. | 维生素c在人体内有重要功能,维生素c不溶于水 | |
| D. | 钾是人体必需的微量元素,食盐的主要成分是KCl |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com