
| A. | c(F-)>c(OH-)>c(HCN)>c(HF) | B. | c(F-)+c(HF)>c(CN-)+c(HCN) | ||
| C. | c(OH-)>c(F-)>c(CN-)>c(H+) | D. | c(OH-)>c(HF)>c(HCN)>c(H+) |
分析 电离常数Ki(HF)>Ki(HCN),根据越弱越水解可知:c(HCN)>c(HF),再根据水解反应CN-+H2O?HCN+OH-、F-+H2O?HF+OH-、H2O?H++OH-可知:c(OH-)>c(HCN)>c(HF);在盐溶液中,阴、阳离子为主要离子,故c(F-)>c(OH-)>c(HCN)>c(HF);根据物料守恒可知:c(Na+)=c(F-)+c(HF)=c(CN-)+c(HCN),据此进行解答.
解答 解:由于电离常数Ki(HF)>Ki(HCN),根据越弱越水解可知,c(HCN)>c(HF),故D错误;
再根据水解反应CN-+H2O?HCN+OH-、F-+H2O?HF+OH-、H2O?H++OH-可知:c(OH-)>c(HCN)>c(HF);
在盐溶液中,阴、阳离子为主要离子,故c(F-)>c(OH-)>c(HCN)>c(HF),故A正确,C错误;
根据物料守恒可知:c(Na+)=c(F-)+c(HF)=c(CN-)+c(HCN),故B错误;
根据分析可知,正确的为A,
故选A.
点评 本题考查了离子浓度大小比较,题目难度中等,明确酸性强弱与电离平衡常数的关系为解答关键,注意掌握盐的水解原理及其影响,试题培养了学生的分析能力及灵活应用能力.


科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:推断题

 .
. ;
; .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②④ | B. | ②③ | C. | ①③ | D. | ①④ |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题

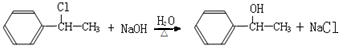 .
.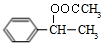 .
.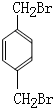 (填结构简式)
(填结构简式)查看答案和解析>>
科目:高中化学 来源: 题型:填空题
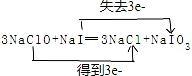 ,还原剂与氧化剂的物质的量之比是1:3.
,还原剂与氧化剂的物质的量之比是1:3.查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 ;Z的化学式为SiO2.
;Z的化学式为SiO2.查看答案和解析>>
科目:高中化学 来源: 题型:推断题
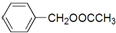 是其中的一种,它可以从茉莉花中提取,也可以用甲苯和乙醇为原料进行人工合成.一种合成路线如下:
是其中的一种,它可以从茉莉花中提取,也可以用甲苯和乙醇为原料进行人工合成.一种合成路线如下: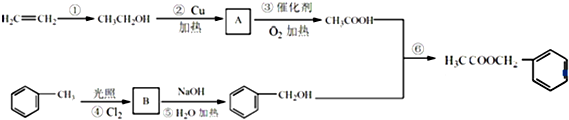
 ;
; ,
,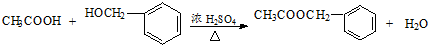 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:解答题

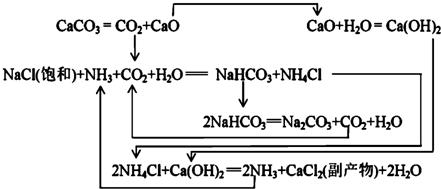
| NaCl | NH4Cl | NaHCO3 | NH4HCO3 | Na2CO3 |
| 35.9 | 37.2 | 9.6 | 21.7 | 21.5 |

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com