
| A. | 含氧酸的酸性:H3ZO4>H2YO4>HXO4 | |
| B. | 非金属性:X>Y>Z | |
| C. | 气态氢化物的稳定性按X、Y、Z顺序由弱到强 | |
| D. | 元素的负化合价的绝对值按X、Y、Z顺序由小到大 |
分析 同周期的X、Y、Z三种主族元素,它们最高价氧化物对应的水化物是HXO4、H2YO4、H3ZO4,则X、Y、Z的最高正化合价分别为+7、+6、+5,则原子序数X>Y>Z.,
A.同周期自左而右非金属性增强,非金属性越强,最高价含氧酸的酸性越强;
B.同周期自左而右非金属性增强;
C.非金属性越强,氢化物越稳定;
D.最低负化合价=最高正化合价-8.
解答 解:同周期的X、Y、Z三种主族元素,它们最高价氧化物对应的水化物是HXO4、H2YO4、H3ZO4,则X、Y、Z的最高正化合价分别为+7、+6、+5,则原子序数X>Y>Z,
A.同周期自左而右非金属性增强,故非金属性X>Y>Z,非金属性越强,最高价含氧酸的酸性越强,故含氧酸的酸性大小为:H3ZO4<H2YO4<HXO4,故A错误;
B.同周期自左而右非金属性增强,故非金属性X>Y>Z,故B正确;
C.非金属性X>Y>Z,非金属性越强,氢化物越稳定,故氢化物稳定性按X、Y、Z顺序由强到弱,故C错误;
D.X、Y、Z最低负化合价分别为-1、-2、-3,负化合价的绝对值依次增大,故D错误,
故选B.
点评 本题考查性质与位置关系、元素周期律等知识,题目难度中等,侧重对元素周期律的可知,注意理解掌握同周期元素性质递变规律,试题培养了学生的灵活应用能力.


科目:高中化学 来源: 题型:选择题
| A. | 碳元素的平均相对原子质量 | B. | 碳原子质量 | ||
| C. | 同位素C-12的行相原子质量 | D. | C-12的质量数 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用25ml的碱式滴定管量取14.80mlNaOH溶液 | |
| B. | 用100ml量筒量取5.2ml的盐酸 | |
| C. | 用托盘天平称取25.20gNaCl | |
| D. | 用100ml容量瓶配制50ml1.0mol/L盐酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
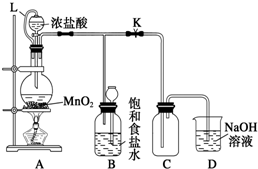
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铁矿石在高温下被氧化成铁 | B. | 生铁中杂质被氧化 | ||
| C. | 铁矿石在高温下被焦炭还原成铁 | D. | 铁矿石在高温下被CO还原成铁 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
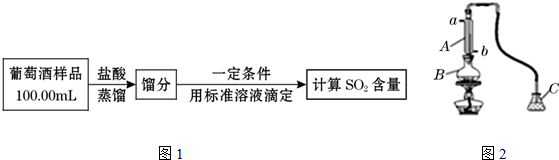
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com