
从下列事实所列出的相应结论正确的是
| 实验事实 | 结论 | |
| A | Cl2的水溶液可以导电 | Cl2是电解质 |
| B | SO2通入硝酸钡溶液出现白色沉淀 | BaSO3不溶于强酸 |
| C | NaHCO3溶液与NaAlO2溶液混合产生白色沉淀 | 结合H+的能力:CO32-<AlO2- |
| D | 常温下白磷可自燃,而氮气须在放电时才与氧 气反应 | 非金属性:P>N |
【知识点】电解质定义、元素非金属性比较D2 E2
【答案解析】C 解析:A、Cl2的水溶液可以导电是因为生成的盐酸和次氯酸电离,而Cl2不是电解质也不是非电解质,故A错误;B、SO2通入硝酸钡溶液出现白色沉淀为BaSO4,故B错误;C、NaHCO3溶液与NaAlO2溶液混合产生白色沉淀是因为AlO2-得到质子,结合H+的能力:CO32-<AlO2-故C正确;D、常温下白磷可自燃,而氮气须在放电时才与氧气反应,不能说明氮、磷的非金属性强弱,硝酸比磷酸酸性强,说明非金属性:N>P,故D错误。
故答案选C
【思路点拨】本题考查了电解质定义、元素非金属性比较等问题,要理解元素非金属性比较的方法。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
某合成气的主要成分是一氧化碳和氢气,可用于合成甲醚等清洁燃料。由天然气获得该合成气过程中可能发生的反应有:
①CH4(g)+H2O(g)CO(g)+3H2(g) ΔH1=+206.1 kJ·mol-1
②CH4(g)+CO2(g)2CO(g)+2H2(g) ΔH2=+247.3 kJ·mol-1
③CO(g)+H2O(g)CO2(g)+H2(g) ΔH3
请回答下列问题:
(1)在一密闭容器中进行反应①,测得CH4的物质的量浓度随反应时间的变化如图1所示。

图1
反应进行的前5 min内,v(H2)=________;10 min时,改变的外界条件可能是______________________________________________________________。
(2)如图2所示,在甲、乙两容器中分别充入等物质的量的CH4和CO2,使甲、乙两容器初始容积相等。在相同温度下发生反应②,并维持反应过程中温度不变。已知甲容器中CH4的转化率随时间的变化如图3所示,请在图3中画出乙容器中CH4的转化率随时间变化的图像。

(3)反应③中ΔH3=________。800 ℃时,反应③的平衡常数K=1,测得该温度下密闭容器中某时刻各物质的物质的量见下表:
| CO | H2O | CO2 | H2 |
| 0.5 mol | 8.5 mol | 2.0 mol | 2.0 mol |
此时反应③中正、逆反应速率的关系式是________(填代号)。
a.v正>v逆 B.v正<v逆
c.v正=v逆 D.无法判断
(4)用该合成气制取甲醚的化学方程式为______________________________。
该反应的原子利用率为________(设反应完全进行,用质量百分比表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
英国天文学家在人马座附近发现了一片酒精云,这片酒精云的质量达100万亿亿吨。现有如图转化关系,下列说故不正确的是
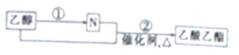
A. N为乙酸
B. 过程①中可加入LiAlH4等还原剂将乙醇转化为N
C. 过程②如果加热一段时间后发现忘记加瓷片,应停止反应,待冷却后补加
D. 可用饱和碳酸钠溶液除去乙酸乙酯中混有的N
查看答案和解析>>
科目:高中化学 来源: 题型:
金属钛性能优越,被誉为继Fe、Al后应用广泛的“第三金属”。
(1)Ti基态原子的电子排布式为
(2)钛能与B、C、 N、 O等非金属元素形成稳定的化合物。电负性:C (填“>”或“<”下同)B;第一电离能: N O。
(3)月球岩石——玄武岩的主要成分为钛酸亚铁(FeTiO3) 。 FeTiO3与80%的硫酸反应可 生成TiOSO4。SO42-的空间构型为 形,其中硫原子采用 杂化.
(4)磷酸钛〔Ti3 (PO4 )4]锂离子电池能量密度大、安全性高。Ti3 (PO4 )4可由TiOSO4与
 H3PO4反应制得。两分子H3PO4发生脱水生成焦磷酸;
H3PO4反应制得。两分子H3PO4发生脱水生成焦磷酸;
则三分子H3PO4脱去两分子H2O生成三磷酸,其结构式为 ,四分子H3PO4 脱去四分子H2O生成的四偏磷酸属于 元酸。
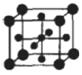
(5)Ti的氧化物和CaO相互作用能形成钛酸盐CaTiO3,CaTiO3的晶体结构如图所示(Ti4+位于立方体的顶点)。该晶体中,Ti4+和周围 个O2-相紧邻.
(6)Fe能形成多种氧化物,其中FeO晶胞结构为NaCI型。晶体中实际上存在空位、错位、杂质原子等缺陷,晶体缺陷对晶体的性质会产生重大影响。由于晶体缺陷,在晶体中Fe和O的个数比发生了变化,变为FexO(x<1)中,若测得某FexO晶体密度为5.71 g·cm-3,晶胞边长为4.28X10-10 m,则FexO中x=_。
查看答案和解析>>
科目:高中化学 来源: 题型:
短周期元素X、Y、Z的原子序数依次递增,其原子的最外层电子数之和为14。X与Y、Z位于相邻周期,Z原子最外层电子数是X原子内层电子数的3倍或者Y原子最外层电子数的2倍。下列说法不正确的是( )
A.X的氢化物溶液与其最高价氧化物对应的水化物溶液的酸碱性相反
B.Y的氧化物既可与强酸反应又可与强碱反应,并可用来制作耐火材料
C.X和Z的最高价氧化物对应的水化物的浓溶液都是具有强氧化性的酸
D.Z的氢化物比X的氢化物更稳定
查看答案和解析>>
科目:高中化学 来源: 题型:
A、B、C、D、E、F、G、L、I九种主族元素分布在三个不同的短周期,它们的原子序数依次增大,其中B、C、D为同一周期,A与E、B与G、D与L分别为同一主族,C、D、F三种元素的原子序数之和为28,F的质子数比D多5,D的最外层电子数是F的2倍,C和D的最外层电子数之和为11。请回答下列问题:
(1)以上非金属元素中所形成的最简单气态氢化物稳定性最弱的是(填化学式) ;E、F、L、I所形成的简单离子的半径由大到小的顺序为(用离子符号表示) 。
(2)由L、I两元素可按原子个数比1:1组成化合物X,化合物X中各原子均满足8电子的稳定结构,则X的电子式为 。固体化合物E2D2投入到化合物E2L的水溶液中,只观察到有沉淀产生的,写出该反应的离子方程式 。
(3)在10 L的密闭容器中,通入2 mol LD2气体和1 mol D2气体,一定温度下反应后生成LD3气体,当反应达到平衡时,D2的浓度为0.01 mol·L-1,同时放出约177 KJ的热量,则平衡时LD2的转化率为 ;该反应的热化学方程式为: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
短周期主族元素A、B、C、D、E的原子序数依次增大,其中只有C是金属元素,B是地壳中含量最多的元素,A元素常见化合价为+1和-1;A与C的最外层电子数相同,C、D两元素原子的电子数之和为A、B两种元素原子的电子数之和的3倍。下列叙述正确的是
A.元素的原子半径:A<B<C< D< E ( )
B.对应氢化物的热稳定性:D > E
C.B与C、B与D形成的化合物中化学键类型相同
D.五种元素中最高价氧化物对应的水化物酸性最强的是E
查看答案和解析>>
科目:高中化学 来源: 题型:
下图是某药物中间体的结构示意图
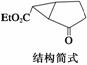
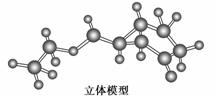
试回答下列问题:
(1)观察上面的结构简式与立体模型,通过对比指出结构简式中的“Et”表示________(填名称);该药物中间体分子的化学式为______________。
(2)请你根据结构示意图,推测该化合物所能发生的反应及所需反应条件__________(写两种)。
(3)解决有机分子结构问题的最强有力手段是核磁共振氢谱(PMR)。有机化合物分子中有几种化学环境不同的氢原子,在PMR中就有几个不同的吸收峰,吸收峰的面积与H原子数目成正比。
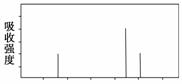
现有一种芳香化合物与该药物中间体互为同分异构体,其模拟的核磁共振氢谱图如上图所示,试写出该化合物的结构简式:____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
准确称取某种铁的氧化物2.88 g,用足量的CO进行还原,将生成的CO2全部用足量的澄清石灰水吸收,得到沉淀4 g,则这种铁的氧化物为 ( )
A. Fe3O4 B.Fe2O3 C. FeO D.以上都不是
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com