
一定条件下,反应![]() ,下列哪一种状态可能没有达到化学反应限度:
,下列哪一种状态可能没有达到化学反应限度:
A.速率比:V(NO2):V(NO):V(O2)=2:2:l时的状态
B.混合气体的平均相对分子质量保持不变时的状态
C.生成NO2的速率与生成O2的速率比等于2:l时的状态
D.体系中的颜色保持不变时的状态
 口算小状元口算速算天天练系列答案
口算小状元口算速算天天练系列答案科目:高中化学 来源: 题型:阅读理解
 化学学科中的平衡理论主要包括:化学平衡、电离平衡、水解平衡和溶解平衡四种,且均符合勒夏特列原理.请回答下列问题:
化学学科中的平衡理论主要包括:化学平衡、电离平衡、水解平衡和溶解平衡四种,且均符合勒夏特列原理.请回答下列问题:| c(CH3OH) |
| c(CO)c2(H2) |
| c(CH3OH) |
| c(CO)c2(H2) |
| 2nB |
| 3tB |
| 2nB |
| 3tB |
| O | 2- 3 |
查看答案和解析>>
科目:高中化学 来源:2011-2012学年浙江省宁波市八校高二下学期期末联考化学试卷(带解析) 题型:填空题
(14分)能源短缺是人类面临的重大问题。甲醇是一种可再生能源,具有广泛的开发和应用前景,因此甲醇被称为21世纪的新型燃料。工业上用CO生产燃料甲醇,一定条件下发生反应:CO(g)+2H2(g) CH3OH(g)。图1表示反应中能量的变化;图2表示一定温度下,在体积为2L的密闭容器中加入4mol H2和一定量的CO后,CO和CH3OH(g)的浓度随时间变化图。
CH3OH(g)。图1表示反应中能量的变化;图2表示一定温度下,在体积为2L的密闭容器中加入4mol H2和一定量的CO后,CO和CH3OH(g)的浓度随时间变化图。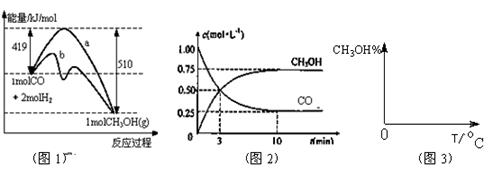
请回答下列问题:
(1)在“图1”中,曲线 (填“a”或“b”)表示使用了催化剂;该反应属于 (填“吸热”或“放热”)反应。
(2)根据“图2”判断,下列说法不正确的是
| A.起始充入的CO为1mol |
| B.增加CO浓度,CO的转化率增大 |
| C.容器中压强恒定时,反应已达平衡状态 |
| D.保持温度和密闭容器容积不变,再充入1molCO和2molH2,再次达到平衡时n(CH3OH)/n(CO)会增大 |
 CH3OH(g)的化学平衡常数为 。若保持其它条件不变,将反应体系升温,则该反应的化学平衡常数将 (填“增大”、“减小”或“不变”)。
CH3OH(g)的化学平衡常数为 。若保持其它条件不变,将反应体系升温,则该反应的化学平衡常数将 (填“增大”、“减小”或“不变”)。查看答案和解析>>
科目:高中化学 来源:2010届云南省高三高考冲刺卷(五)理科综合化学试题 题型:填空题
(15分)以下是元素周期表的示意图,请参照①~⑧在表中的位置,用化学用语回答下列问题:

(1)元素②和⑤的单质和化合物之间在一定条件下存在反应: ,其中
,其中 为直线形的非极性分子。
为直线形的非极性分子。 的结构式为_________。
的结构式为_________。
(2)元素③的气态氢化物与最高价氧化物对应的水化物之间可以反应生成盐,该盐在实际生活中的一种用途为___________________________。
(3)元素⑥的单质既能与强酸反应,又能与强碱反应,且元素⑥的单质可以在高温条件下还原三氧化二铁。该反应的化学方程式为___________________________。
(4)由表中两种元素的原子按1:1组成的常见液态化合物的稀溶液易被催化分解,可使用的催化剂为_________(填一种物质的化学式)。
(5)由表中元素形成的常见物质X、Y、Z、M、N可发生如下反应:

①X溶液与Y溶液反应的离子方程式为___________________________。
② ⑥的单质化学方程式为___________________________。
⑥的单质化学方程式为___________________________。
③常温下,为使 溶液中由
溶液中由 电离的阴、阳离子浓度相等,应向溶液中加入一定量的Y溶液至__________________。
电离的阴、阳离子浓度相等,应向溶液中加入一定量的Y溶液至__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
以下是元素周期表的示意图,请参照①~⑧在表中的位置,用化学用语回答下列问题:
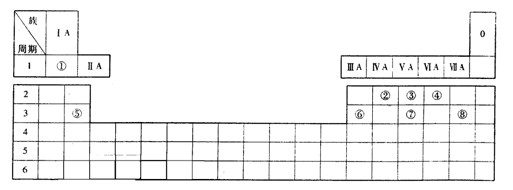
(1)元素②和⑤的单质和化合物之间在一定条件下存在反应:![]() ,其中
,其中![]() 为直线形的非极性分子。
为直线形的非极性分子。![]() 的结构式为_________。
的结构式为_________。
(2)元素③的气态氢化物与最高价氧化物对应的水化物之间可以反应生成盐,该盐在实际生活中的一种用途为___________________________。
(3)元素⑥的单质既能与强酸反应,又能与强碱反应,且元素⑥的单质可以在高温条件下还原三氧化二铁。该反应的化学方程式为___________________________。
(4)由表中两种元素的原子按1:1组成的常见液态化合物的稀溶液易被催化分解,可使用的催化剂为_________(填一种物质的化学式)。
(5)由表中元素形成的常见物质X、Y、Z、M、N可发生如下反应:

①X溶液与Y溶液反应的离子方程式为___________________________。
②![]() ⑥的单质化学方程式为___________________________。
⑥的单质化学方程式为___________________________。
③常温下,为使![]() 溶液中由
溶液中由![]() 电离的阴、阳离子浓度相等,应向溶液中加入一定量的Y溶液至__________________。
电离的阴、阳离子浓度相等,应向溶液中加入一定量的Y溶液至__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
(15分)以下是元素周期表的示意图,请参照①~⑧在表中的位置,用化学用语回答下列问题:
(1)元素②和⑤的单质和化合物之间在一定条件下存在反应:![]() ,其中
,其中![]() 为直线形的非极性分子。
为直线形的非极性分子。![]() 的结构式为_________。
的结构式为_________。
(2)元素③的气态氢化物与最高价氧化物对应的水化物之间可以反应生成盐,该盐在实际生活中的一种用途为___________________________。
(3)元素⑥的单质既能与强酸反应,又能与强碱反应,且元素⑥的单质可以在高温条件下还原三氧化二铁。该反应的化学方程式为___________________________。
(4)由表中两种元素的原子按1:1组成的常见液态化合物的稀溶液易被催化分解,可使用的催化剂为_________(填一种物质的化学式)。
(5)由表中元素形成的常见物质X、Y、Z、M、N可发生如下反应:
①X溶液与Y溶液反应的离子方程式为___________________________。
②![]() ⑥的单质化学方程式为___________________________。
⑥的单质化学方程式为___________________________。
③常温下,为使![]() 溶液中由
溶液中由![]() 电离的阴、阳离子浓度相等,应向溶液中加入一定量的Y溶液至__________________。
电离的阴、阳离子浓度相等,应向溶液中加入一定量的Y溶液至__________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com