
【题目】游离态氮称为惰性氮,游离态氮转化为化合态氮称之为氮的活化,在氮的循环系统中,氮的过量“活化”,则活化氮开始向大气和水体过量迁移,氮的循环平衡被打破,导致全球环境问题。
Ⅰ.氮的活化

工业合成氨是氮的活化重要途径之一,在一定条件下,将N2 和 H2 通入到体积为0.5L的恒容容器中,反应过程中各物质的物质的量变化如右图所示:(1)10min内用NH3表示该反应的平均速率,v(NH3)=____________。
(2)在第10min和第25min改变的条件可能分别是_________、________(填字母)。
A.加了催化剂
B. 升高温度
C. 增加NH3的物质的量
D.压缩体积
E.分离出氨气
(3)下列说法能说明该可逆反应达到平衡状态的是__________(填字母)。
A.容器中气体密度不变
B. 容器中压强不变
C.3v(H2)正=2v(NH3)逆
D. N2、H2、NH3分子数之比为1∶3∶2
Ⅱ.催化转化为惰性氮 已知:SO2、CO、NH3等都可以催化还原氮氧化物生成惰性氮。
(4)在25℃,101KPa时,N2(g)+3H2(g) ![]() 2NH3(g) △H1= -92.4kJ/mol
2NH3(g) △H1= -92.4kJ/mol
2H2(g)+O2(g)=2H2O(l) △H2= -571.6kJ/mol
N2(g)+O2(g)=2NO(g) △H3= +180kJ/mol
则NO与NH3反应生成惰性氮的热化学方程式______________________________。
(5)在有氧条件下,新型催化剂M能催化CO与NOx反应生成N2。现向某密闭容器中充入等物质的量浓度的NO2和CO气体,维持恒温恒容,在催化剂作用下发生反应:4CO(g)+2NO2(g)![]() N2(g)+4CO2(g) △H<0,相关数据如下:
N2(g)+4CO2(g) △H<0,相关数据如下:
0min | 5min | 10min | 15min | 20min | |
c(NO2) /mol·L-1 | 2.0 | 1.7 | 1.56 | 1.5 | 1.5 |
c(N2) /mol·L-1 | 0 | 0.15 | 0.22 | 0.25 | 0.25 |
计算此温度下的化学平衡常数K=______,
②实验室模拟电解法吸收NOx装置如图,(图中电极均为石墨电极)。若用NO2气体进行模拟电解法吸收实验(a<b),电解时NO2发生反应的电极反应式:_____________。

【答案】0.02mol·L-1·min-1 AB E B 6NO(g)+4NH3(g)=5 N2(g)+6H2O(l) △H=-2070 kJ·mol-1 ①1/9(或0.11)(mol·L-1)-1(单位可以不写) ②H2O+NO2-e- = NO3-+2H+
【解析】
Ⅰ(1)根据图像利用v=![]() 进行计算;
进行计算;
(2)通过观察图像瞬间变化点和后续物质的量变化的快慢,确定反应条件的改变;
(3)反应过程中变化的物理量不再改变说明反应达到了平衡;
Ⅱ.(4)利用盖斯定律解题;
(5)利用利用三行式法进行计算;
②观察图像可知二氧化氮生成硝酸,化合价升高失电子。
Ⅰ.(1)10min内用NH3表示该反应的平均速率,v(NH3)=![]() =
=![]() =0.02mol·L-1·min-1;
=0.02mol·L-1·min-1;
答案:0.02mol·L-1·min-1。
(2)在第10min时刻反应物和生成物的量并没有瞬间改变,容器容积又恒定,说明浓度没变,10min到20min的时候,发现速率加快,因为体积未变,不可能增大压强,猜测升温或者加入了催化剂;第25min时刻发现氨气的物质的量瞬间减少,所以改变的条件应该是分理出氨气;
正确答案: AB E。
(3)A. 容器中气体密度=![]() ,根据质量守恒定律,气体总质量是定值,又因为恒容,所以密度在反应过程中始终是定值,不可作为是否达到平衡状态的依据,A错误;
,根据质量守恒定律,气体总质量是定值,又因为恒容,所以密度在反应过程中始终是定值,不可作为是否达到平衡状态的依据,A错误;
B. T、V一定时,反应正向进行,气体的物质的量一直减少,压强在减小,当容器中压强不变时,化学反应达到平衡状态,B正确;
C.正逆反应速率比不等于化学计量数之比,并未达到平衡,C错误;
D.平衡时各物质的分子数之比取决于物质的起始物质的量和转化率,故N2、H2、NH3的分子数之比为1:3:2不能作为判断是否达到平衡状态的依据,D错误;
答案:B
Ⅱ.(4)根据盖斯定律②×3-①×2-③×3得NO与NH3反应生成惰性氮的热化学方程式6NO(g)+4NH3(g)=5 N2(g)+6H2O(l) △H=-2070 kJ·mol-1;
答案:6NO(g)+4NH3(g)=5 N2(g)+6H2O(l) △H=-2070 kJ·mol-1。
(5)根据表格数据列三行式
4CO(g)+2NO2(g)![]() N2(g)+ 4CO2(g)
N2(g)+ 4CO2(g)
c(初) 2.0 2.0 0 0
△c 1.0 0.5 0.25 1.0
c(平) 1.0 1.5 0.25 1.0
K=![]() =1/9(或0.11)
=1/9(或0.11)
答案:1/9(或0.11)(mol·L-1)-1(单位可以不写)。
②根据图像可知,NO2化合价升高失电子生成硝酸根离子,电解时NO2发生反应的电极反应式:H2O+NO2-e- = NO3-+2H+;
答案:H2O+NO2-e- = NO3-+2H+。


科目:高中化学 来源: 题型:
【题目】(题文)[化学——选修5:有机化学基础]
近来有报道,碘代化合物E与化合物H在Cr-Ni催化下可以发生偶联反应,合成一种多官能团的化合物Y,其合成路线如下:
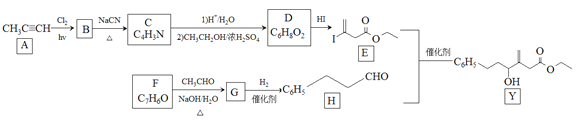
已知:![]()
回答下列问题:
(1)A的化学名称是________________。
(2)B为单氯代烃,由B生成C的化学方程式为________________。
(3)由A生成B、G生成H的反应类型分别是________________、________________。
(4)D的结构简式为________________。
(5)Y中含氧官能团的名称为________________。
(6)E与F在Cr-Ni催化下也可以发生偶联反应,产物的结构简式为________________。
(7)X与D互为同分异构体,且具有完全相同官能团。X的核磁共振氢谱显示三种不同化学环境的氢,其峰面积之比为3∶3∶2。写出3种符合上述条件的X的结构简式________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.实验室用密度为1.25 g·mL-1、质量分数为36.5%的浓盐酸配制250 mL 1.0 mol·L-1的稀盐酸,请回答下列问题:
(1)所需量取浓盐酸的体积为________ml。
(2)配制时,其正确的操作顺序是________。
A.用30 mL水洗涤烧杯内壁和玻璃棒2~3次,洗涤液均注入容量瓶,振荡
B.用量筒准确量取所需的浓盐酸的体积,倒入烧杯中,再加入适量水,用玻璃棒慢慢搅动,使其混合均匀
C.将已冷却的盐酸沿玻璃棒注入容量瓶中
D.将容量瓶盖紧,振荡,摇匀
E.改用胶头滴管加水,使溶液凹液面恰好与刻度线相切
F.继续往容量瓶内小心加水,直到液面接近刻度线 1~2 cm处
(3)若实验中进行如下操作,使配制盐酸的物质的量浓度偏高的为____________
使配制盐酸的物质的量浓度偏低的为____________
①用于稀释盐酸的烧杯未洗涤②容量瓶中原有少量蒸馏水③定容时俯视观察液面
④定容摇匀后发现液面下降⑤量取浓盐酸时仰视刻度线⑥转移时有部分液体洒出
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)下列物质①Cu ②SO2 ③NaCl溶液 ④HCl ⑤BaSO4 ⑥NH3 ⑦酒精 ⑧稀硫酸⑨NaOH晶体 ⑩氯水; 其中属于电解质的有_________;属于非电解质的有_________。
(2)瓦斯中甲烷与氧气的质量比为1:4时极易爆炸,此时甲烷与空气的体积比为_____。
(3)已知16 g A和20 g B恰好完全反应生成0.04 mol C和31.76 g D,则C的摩尔质量为 ________________________________ 。
(4)标况下11.2L 甲烷和乙烯(C2H4)的气体混合物中含有氢原子的数目为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列溶液中,溶质的物质的量浓度为1molL-1 的是( )
A.将40gNaOH溶于1 L 水所得的溶液
B.往100mL2molL-1的NaNO3溶液中加入100 mL水所得的溶液
C.将16g CuSO4·5H2O溶于水配成100mL的溶液
D.含K+为2 molL-1的K2SO4溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】洛索洛芬钠可用于类风湿性关节炎、肩周炎等炎症的消炎,其合成路线如下:

已知:i、![]()
ii、![]()
iii、
(以上R、![]() 代表烃基)
代表烃基)
(1)A属于芳香烃,其结构简式是_______________。
(2)B的结构简式是__________,D中含有官能团的名称是_____________。
(3)E属于烯烃。E与B2反应生成F的化学方程式是____________________________。
(4)反应①的化学方程式是_________________。反应②的反应类型是______________。
(5)将J和NaOH溶液混合搅拌后,再加入乙醇有大量白色固体K析出,则K的结构简式是____________。
(6)与 互为同分异构体,且符合下列要求的结构共有_______种。
互为同分异构体,且符合下列要求的结构共有_______种。
①结构中含有苯环,且苯环上只有两个取代基
②能在NaOH溶液中发生水解反应
③能和银氨溶液产生银镜
(7)以乙烯为起始原料,结合已知信息选用必要的无机试剂合成聚丁二酸乙二醇酯(  ),写出最多不超过5步的合成路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)。_____________________
),写出最多不超过5步的合成路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)。_____________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某一条肽链由10个氨基酸组成,利用水解法I可得到四个片段,即:A-P;H-V;G-L-B-T;C-T.利用水解法Ⅱ可得到三个片段,即:A-P-G-L;T-H-V;B-T-C.(其中字母表示氨基酸,“-”表示肽键)。从有重叠结构的各个肽的顺序中可推断出该十肽的氨基酸序列为( )
A. A-P-H-V-G-L-B-T-C-TB. A-P-G-L-B-T-C-T-H-V
C. T-H-V-A-P-G-L-B-T-CD. G-L-B-T-A-P-H-V-C-T
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知溶液中存在平衡:Ca(OH)2(s)![]() Ca2+(aq)+2OH-(aq) △H<0,下列有关该平衡体系的说法正确的是( )
Ca2+(aq)+2OH-(aq) △H<0,下列有关该平衡体系的说法正确的是( )
①升高温度,平衡逆向移动
②向溶液中加入少量碳酸钠粉末能增大钙离子浓度
③恒温下向溶液中加入CaO,溶液的pH升高
④加热溶液,溶液的pH升高
⑤向溶液中加人Na2CO3溶液,其中固体质量增加
⑥向溶液中加入少量NaOH固体,Ca(OH)2固体质量不变
A. 仅①⑤ B. 仅①⑤⑥ C. 仅②③⑤ D. 仅①②⑤⑥
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com