



 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
 (2008?山东)某温度时,BaSO4在水中的沉淀溶解平衡曲线如图所示.下列说法正确的是( )
(2008?山东)某温度时,BaSO4在水中的沉淀溶解平衡曲线如图所示.下列说法正确的是( )查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
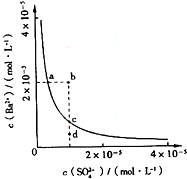
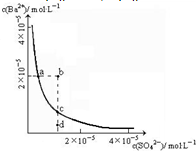 BaSO4在水中存在沉淀溶解平衡BaSO4(s)═Ba2+(aq)+SO42-(aq),溶度积常数Ksp=c(Ba2+)?c(SO42-).
BaSO4在水中存在沉淀溶解平衡BaSO4(s)═Ba2+(aq)+SO42-(aq),溶度积常数Ksp=c(Ba2+)?c(SO42-).查看答案和解析>>
科目:高中化学 来源: 题型:
| 物质 | △H(kJ/mol) |
| H2(g) | -285.8 |
| CO(g) | -283.0 |
| CH4(g) | -890.3 |
| 4n |
| 4n-2na |
| 4n |
| 4n-2na |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com