
A.断开反应物中的化学键吸收的能量比形成生成物中的化学键放出的能量少
B.断开旧键吸收的能量大于形成新键放出的能量
C.反应物的总能量高于生成物的总能量
D.反应物的总能量低于生成物的总能量
科目:高中化学 来源: 题型:阅读理解
| X的基态原子中电子分布在三个不同的能级中,且每个能级的电子总数相同 |
| Y元素的气态氢化物与其最高价氧化物对应的水化物能发生化学反应 |
| Z元素的族序数是周期数的三倍 |
| W原子的第一至第六电离能分别为:I1=578kJ?mol-1,I2=1817kJ?mol-1, I3=2745kJ?mol-1,I4=11575kJ?mol-1,I5=14830kJ?mol-1,I6=18376kJ?mol-1 |
| Q为前四周期中电负性最小的元素 |
| R位于周期表的第11列 |
 或
或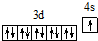
 或
或
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
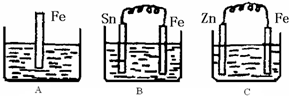
 2Z
2Z 2Z
2Z查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
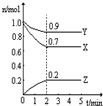
| C2(NH3) |
| C (N2)C3(H2) |
| C2(NH3) |
| C (N2)C3(H2) |
| 1 |
| 2 |
| 3 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源:2011届浙江省海盐元济高级中学高三高考全真压轴考试(理综)化学试题 题型:单选题
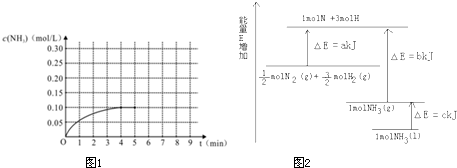
盖斯定律认为能量总是守恒的:化学反应过程一步完成或分步完成,整个过程的热效应是相同的。
已知:①H2O(g)===H2O(l); ΔH=-Q1 kJ/mol
②C2H5OH(g)===C2H5OH(l); ΔH=-Q2 kJ/mol
③C2H5OH(g)+3O2(g)===2CO2(g)+3H2O(g);ΔH=-Q3 kJ/mol
下列判断正确的是
| A.酒精的燃烧热为Q3 kJ |
| B.若使46 g酒精液体完全燃烧,最后恢复到室温,释放出的热量为(3Q1-Q2+Q3)kJ |
| C.H2O(g)→H2O(l)释放出了热量,所以该过程为化学变化 |
| D.从反应③可知1mol C2H5OH(g)能量高于2 mol CO2(g)和3 mol H2O(g)的总能量 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com