
【题目】下列关于氨水的叙述正确的是( )
A.氨水显碱性,是因为氨水是一种弱碱
B.氨水和液氨成分相同
C.氨水中物质的量浓度最大的粒子是NH3(除水外)
D.1mol·L-1的氨水指在1L溶液中含NH3、NH3·H2O、NH4+物质的量之和为1mol
【答案】D
【解析】
A.氨水中的一水合氨(NH3·H2O)可以部分电离成NH4+和OH-,所以氨水显弱碱性,A项错误;
B.氨溶于水的水溶液称为氨水,其中大部分NH3与水结合成一水合氨(NH3·H2O)。氨水的成分为:NH3、NH3·H2O、H2O、NH4+、OH-和H+;液氨为氨气液化而成,液氨的主要成分为NH3。二者成分不相同,B项错误;
C.氨溶于水的水溶液称为氨水,其中大部分NH3与水结合成一水合氨(NH3·H2O)。故氨水中物质的量浓度最大的粒子是一水合氨(NH3·H2O)。C项错误;
D.氨水中存在平衡NH3+H2O![]() NH3·H2O
NH3·H2O![]() NH4++ OH-,根据氮元素守恒可知。1mol·L-1的氨水中
NH4++ OH-,根据氮元素守恒可知。1mol·L-1的氨水中![]() ,则1L 1mol·L-1的氨水含NH3、NH3·H2O、NH4+物质的量之和为1mol,D项正确;
,则1L 1mol·L-1的氨水含NH3、NH3·H2O、NH4+物质的量之和为1mol,D项正确;
答案选D。


 一诺书业暑假作业快乐假期云南美术出版社系列答案
一诺书业暑假作业快乐假期云南美术出版社系列答案科目:高中化学 来源: 题型:
【题目】
镍及其化合物是重要的合金材料和催化剂。请回答下列问题:
(1)基态镍原子的价电子排布式为_____,排布时能量最高的电子所占能级的原子轨道有____个伸展方向。
(2)镍能形成多种配合物如正四面体形的Ni(CO)4 和正方形的[Ni(CN)4]2-、正八面体形的[Ni(NH3)6]2+等。下列说法正确的有___
A.CO与CN-互为等电子体,其中CO分子内σ键和π键个数之比为1:2-
B.NH3的空间构型为平面三角形
C.Ni2+在形成配合物时,其配位数只能为4
D.Ni(CO)4和[Ni(CN)4]2-中,镍元素均是sp3杂化
(3)丁二酮肟常用于检验Ni2+:在稀氨水中,丁二酮肟与Ni2+反应生成鲜红色沉淀,其结构如图所示。该结构中,除共价键外还存在配位键和氢键,请在图中用“→”和“”分别表示出配位键和氢键。_____
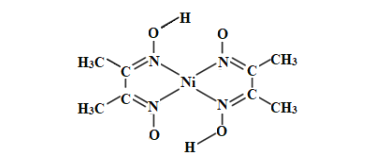
(4)NiO的晶体结构类型与氯化钠的相同,相关离子半径如下表:
![]()
NiO晶胞中Ni2+的配位数为____,NiO熔点比NaCl高的原因是_____。
(5)研究发现镧镍合金LaNix是一种良好的储氢材料。属六方晶系,其晶胞如图a中实线所示,储氢位置有两种,分别是八面体空隙(“![]() ”)和四面体空隙(“
”)和四面体空隙(“![]() ”),见图b、c,这些就是氢原子存储处,有氢时,设其化学式为LaNixHy。
”),见图b、c,这些就是氢原子存储处,有氢时,设其化学式为LaNixHy。
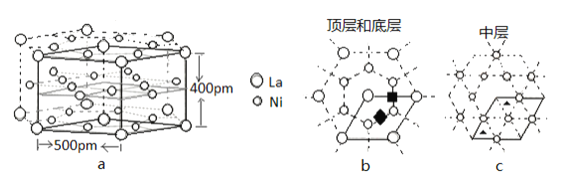
①LaNix合金中x的值为_____;
②晶胞中和“![]() ”同类的八面体空隙有___个,和“
”同类的八面体空隙有___个,和“![]() ”同类的四面体空隙有___个。
”同类的四面体空隙有___个。
③若H进入晶胞后,晶胞的体积不变,H的最大密度是______g/cm-3(保留2位有效数字,NA=6.0×1023,![]() =1.7)
=1.7)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应A+3B![]() 2C+2D在4种不同条件下的反应速率(单位为mol·L-1·s-1)分别为①v(A)=0.15 ②v(B)=0.6 ③v(C)=0.4 ④v(D)=0.45该反应反应速率最快的条件是( )
2C+2D在4种不同条件下的反应速率(单位为mol·L-1·s-1)分别为①v(A)=0.15 ②v(B)=0.6 ③v(C)=0.4 ④v(D)=0.45该反应反应速率最快的条件是( )
A. ② B. ④ C. ①和④ D. ②和③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(12分)已知:I2+2S2O===S4O+2I-。相关物质的溶度积常数见下表:
物质 | Cu(OH)2 | Fe(OH)3 | CuCl | CuI |
Ksp | 2.2×10-20 | 2.6×10-39 | 1.7×10-7 | 1.3×10-12 |
(1)某酸性CuCl2溶液中含有少量的FeCl3,为得到纯净的CuCl2·2H2O晶体,加入 ,(填化学式)调至pH=4,使溶液中的Fe3+转化为Fe(OH)3沉淀,此时溶液中的c(Fe3+)= 。过滤后,将所得滤液低温蒸发、浓缩结晶,可得到CuCl2·2H2O晶体。
(2)在空气中直接加热CuCl2·2H2O晶体得不到纯的无水CuCl2,原因是 (用化学方程式表示)。由CuCl2·2H2O晶体得到纯的无水CuCl2的合理方法是 。
(3)某学习小组用“间接碘量法”测定含有CuCl2·2H2O晶体的试样(不含能与I-发生反应的氧化性杂质)的纯度,过程如下:取0.36 g试样溶于水,加入过量KI固体,充分反应,生成白色沉淀。用0.1000 mol/L Na2S2O3标准溶液滴定,到达滴定终点时,消耗Na2S2O3标准溶液20.00 mL。
①可选用 作滴定指示剂,滴定终点的现象是 。
②CuCl2溶液与KI反应的离子方程式为 。
③该试样中CuCl2·2H2O的质量百分数为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】盐酸和氢氧化钠是工业上重要的化工原料,也是实验室里常见的试剂.
Ⅰ.测定中和热.
写出稀盐酸和稀氢氧化钠溶液反应表示中和热的热化学方程式__________________________
(中和热数值为57.3kJ/mol):
(2)取50mL 0.5mol/L HCl溶液与50mL0.55mol/L NaOH溶液进行测定,但实验数值小于57.3kJ/mol,原因不可能是_______________(填序号).
A.用温度计测定NaOH溶液起始温度后直接测定盐酸的温度
B.量取盐酸的体积时仰视读数
C.分多次把NaOH溶液倒入盛有盐酸的小烧杯中
D.实验装置保温、隔热效果差
Ⅱ.酸碱中和滴定.
欲测定某NaOH溶液的物质的量浓度,可用0.1000 mol·L-1 HCl标准溶液进行中和滴定(用酚酞作指示剂)。请回答下列问题:
(1)若甲学生在实验过程中,记录滴定前滴定管内液面读数为1.10 mL,滴定后液面如图,则此时消耗标准溶液的体积为_________________。

(2)乙学生做了三组平行实验,数据记录如下:
实验序号 | 待测NaOH溶液的体积/mL | 0.1000mol·L-1HCl溶液的体积/mL | |
滴定前刻度 | 滴定后刻度 | ||
1 | 25.00 | 0.00 | 26.11 |
2 | 25.00 | 1.56 | 31.30 |
3 | 25.00 | 0.22 | 26.31 |
选取上述合理数据,计算出待测NaOH溶液的物质的量浓度为________________(小数点后保留四位)。
(3)下列哪些操作会使测定结果偏高___________(填序号)。
A.锥形瓶用蒸馏水洗净后再用待测液润洗
B.酸式滴定管用蒸馏水洗净后再用标准液润洗
C.滴定前酸式滴定管尖端气泡未排除,滴定后气泡消失
D.滴定前读数正确,滴定后俯视滴定管读数
滴定终点的判断__________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是A→E五种含氮物质相互转化的关系图。其中A、B、C、D常温下都是气体,且B为红棕色气体。

(1)写出下列物质的化学式:
A___、B___、C___、D____、E___。
(2)写出下面各步反应的化学方程式:
①___、②___、⑤___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图中,A是单质,B的焰色反应呈黄色。判断A、B、C、D的化学式:

A_____ B______ C______ D______
下列转化的化学方程式为:
(1)A→B__________
(2)B→D________
(3)A→C__________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值,下列说法正确的是
A. 0.1 mol NaHSO4固体中含有的离子总数为0.3NA
B. 1L 1 mo1·L-1的(NH4)2CO3溶液中所含NH4+的数目为2NA
C. 标况下,22.4L Cl2通入水中,转移的电子数为NA
D. 20g D2O含有的中子数为10NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯水中存在多种分子和离子,它们在不同的反应中表现出不同的性质。下列结论正确的是( )
A. 加入有色布条,片刻后有色布条褪色,说明有Cl2存在
B. 溶液呈浅黄绿色,且有刺激性气味,说明有Cl2存在
C. 先加入盐酸酸化,再加入AgNO3溶液,生成白色沉淀,说明有Cl-存在
D. 加入NaOH溶液,氯水的浅黄绿色消失,说明有HClO存在
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com