
| A. | 由原子构成的晶体不一定是原子晶体 | |
| B. | 分子晶体中的分子间可能含有共价键 | |
| C. | 分子晶体中一定有共价键 | |
| D. | 分子晶体中分子一定紧密堆积 |
分析 A.由原子构成的晶体可能是分子晶体;
B.分子晶体中的分子间不可能含有共价键;
C.分子晶体中可能不存在共价键;
D.冰中水分子间存在氢键,不具有分子密堆积特征
解答 解:A.由原子构成的晶体可能是分子晶体,例如稀有气体由原子构成的分子晶体,所以由原子构成的晶体不一定是原子晶体,故A正确;
B.分子晶体中的分子间只存在分子间作用力,不可能含有共价键,故B错误;
C.稀有气体分子晶体中不含共价键,故C错误;
D.冰中水分子间存在氢键,氢键具有方向性,所以分子晶体冰不具有分子密堆积特征,故D错误;
故选A.
点评 本题考查化学键,为高频考点,把握化学键的形成及物质中的化学键为解答的关键,注意稀有气体中不含化学键,侧重分析与应用能力的考查,题目难度不大.


科目:高中化学 来源: 题型:选择题
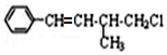 下列叙述不正确的是( )
下列叙述不正确的是( )| A. | 1mol 该有机物在加热和催化剂作用下,最多能和4 mol H2反应 | |
| B. | 该有机物分子式为C11H13Cl | |
| C. | 该有机物能通过加成、消去、水解三步反应生成: | |
| D. | 该有机物遇硝酸银溶液不能产生白色沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 25℃,Cu(OH)2 在水中的溶度积比其在 Cu(NO3)2 溶液中的大 | |
| B. | 一定温度下,将 0.10 mol/L的氨水加水稀释,溶液中各离子浓度均减小 | |
| C. | H3PO2 属于一元弱酸,则 H3PO2 与过量 NaOH 溶液反应的离子方程式为:H3PO2+3OH?═PO23-+3H2O | |
| D. | 常温下,NaHS 溶液中:c(H+)+c(H2S)═c(S2-)+c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 淀粉、油脂、蛋白质在一定条件下都可以发生水解反应 | |
| B. | 溴苯分子中苯环上的一个氢原子被-C4H9原子团取代形成的同分异构体共有12种 | |
| C. | 等物质的量的乙烯和乙醇在氧气中充分燃烧后耗氧量相同 | |
| D. | 甲烷中混有乙烯可以使用溴的四氯化碳溶液或酸性KMnO4溶液除去 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分子式为C3H6Cl2的有机物有4种同分异构体 | |
| B. | 包装用材料聚氯乙烯分子中含有碳碳双键 | |
| C. | 苯与液溴混合后加入铁粉发生了加成反应 | |
| D. | 1mol苹果酸(HOOCCHOHCH2COOH)可与3molNaHCO3发生反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | b g | B. | $\frac{3b}{4}$g | C. | $\frac{b}{2}$g | D. | $\frac{b}{4}$g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 混合物 | 试剂 | 分离方法 | |
| A | 苯(苯酚) | 溴水 | 过滤 |
| B | 乙烷(乙烯) | 氢气 | 加热 |
| C | 乙酸乙酯(乙酸) | NaOH溶液 | 蒸馏 |
| D | 淀粉(氯化钠) | 蒸馏水 | 渗析 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com