
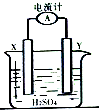
 某同学进行如图所示的铜--锌原电池实验,已知电解质溶液中H+向X极移动.
某同学进行如图所示的铜--锌原电池实验,已知电解质溶液中H+向X极移动.分析 原电池中,活泼金属作负极,负极发生氧化反应,正极发生还原反应,负极反应式为Zn-2e-=Zn2+,正极反应式为2H++2e-=H2↑,原电池中电子由负极流向正极,以此解答该题.
解答 解:(1)电解质溶液中H+向X极移动,X应为正极,则Y为负极,负极为较活泼的金属,为Zn,X为Cu,故答案为:铜;锌;
(2)原电池工作时,铜片上有无色气泡产生,锌片溶解,电流计指针发生偏转,
故答案为:铜片上有无色气泡产生,锌片溶解,电流计指针发生偏转;
(3)如锌片不纯,锌与杂质构成了许多微小的原电池,在锌片上也能生成氢气,故答案为:锌片不纯,锌与杂质构成了许多微小的原电池.
点评 本题考查原电池的工作原理知识,为高频考点,侧重于学生的分析能力的考查,注意正负极的判断以及电解质中阴阳离子的移动是解题的关键,难度不大.


 轻松课堂单元测试AB卷系列答案
轻松课堂单元测试AB卷系列答案 小题狂做系列答案
小题狂做系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 难溶于水,且必须比水的密度大 | |
| B. | 难溶于水,且比水溶解溴的能力强 | |
| C. | 易溶于水,且比水溶解溴的能力弱 | |
| D. | 难溶于水,且必须与溴单质发生化学反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 序号 | 实验内容 | 实验观察 | 离子方程式 | 解释与结论 |
| ① | 在FeCl2溶液中 滴入适量氯水 | 溶液由浅绿色 变为黄色 | 2Fe2++Cl2═2Fe3++2Cl- | Fe2+具有还原性 |
② | 在FeCl2溶液中 加入锌片 | / | Zn+Fe2+=Zn2+ +Fe | Fe2+具有氧化性 |
| ③ | 在FeCl3溶液中 加入足量铁粉 | 溶液由黄色变成浅绿色 | Fe+2Fe3+═3Fe2+ | Fe3+具有氧化性 |
④ | 在FeCl3溶液中 通入H2S气体 | 溶液变为浅绿色并 有淡黄色沉淀生成 | H2S+2Fe3+=2Fe2++S↓+2H+ | Fe3+具有氧化性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 |  |  | 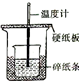 |
| A.测量锌与稀硫酸反应的速率 | B.构造铜锌原电池 | C.进行酸碱中和滴定实验 | D.测定中和热 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 与少量乙二醛混合可制备乙二酸 | |
| B. | 与浓盐酸反应的离子方程式为:2MnO4-+16 H++10Cl-=5Cl2↑+2Mn2++8 H20 | |
| C. | 与K+、NO3-、SO42-、CO32-可以大量共存 | |
| D. | 与过量Na202混合后,共转移e-0.05mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
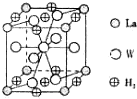 有A、B、C、D、E、F、G、W八种原子序数依次增大的元素(原子序数均小于30),A原子的核外电子数与电子层数相等,B的基态原子有3个不同的能级且各能级中电子数相等,D的基态原子与B的基态原子的未成对电子数目相同,E的基态原子s能级的电子总数与p能级的电子数相等,E、F同主族,G与W同周期同族且原子序数相差2.请回答下列问题:
有A、B、C、D、E、F、G、W八种原子序数依次增大的元素(原子序数均小于30),A原子的核外电子数与电子层数相等,B的基态原子有3个不同的能级且各能级中电子数相等,D的基态原子与B的基态原子的未成对电子数目相同,E的基态原子s能级的电子总数与p能级的电子数相等,E、F同主族,G与W同周期同族且原子序数相差2.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
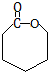
 和高分子化合物PCL的合成路线如下:
和高分子化合物PCL的合成路线如下:
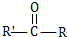 $\stackrel{过氧化物}{→}$
$\stackrel{过氧化物}{→}$ (R、R′代表烃基)
(R、R′代表烃基)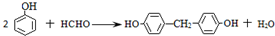 .
. .
. .高分子化合物PCL的结构简式是
.高分子化合物PCL的结构简式是 .
. 、
、 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 石油的分馏、煤的干馏、石油的裂解都是化学变化 | |
| B. | 袋装食品常用生石灰作为食品的抗氧化剂 | |
| C. | 金属焊接时可用饱和NH4Cl溶液作除锈剂 | |
| D. | 泡沫灭火器的内筒为塑料桶,盛有碳酸氢钠溶液;外筒为铁桶,外筒和内筒之间装有硫酸铝溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com