
【题目】氯碱工业以电解精制饱和食盐水的方法制取氯气、氢气、烧碱和氯的含氧酸盐等系列化工产品。下图是离子交换膜法电解食盐水的示意图,图中的离子交换膜只允许阳离子通过。完成下列填空:
(1)写出电解饱和食盐水的离子方程式________________。
(2)离子交换膜的作用为____________________。
(3)精制饱和食盐水从图中________位置补充,氢氧化钠溶液从图中________位置流出。(选填“a”、“b”、“c”或“d”)

【答案】 2Cl-+H2O![]() 2OH-+H2↑ +Cl2↑ 阳离子交换膜只能阳离子通过,阴离子和气体不能通过,用石墨作电极电解饱和氯化钠时,阳极上氯离子放电生成氯气,氯气不能通过阳离子交换膜而进入阴极,如果氯气进入阴极易和氢气混合产生爆炸,且易和氢氧化钠溶液反应生成氯化钠、次氯酸钠而导致制取的氢氧化钠不纯 a d
2OH-+H2↑ +Cl2↑ 阳离子交换膜只能阳离子通过,阴离子和气体不能通过,用石墨作电极电解饱和氯化钠时,阳极上氯离子放电生成氯气,氯气不能通过阳离子交换膜而进入阴极,如果氯气进入阴极易和氢气混合产生爆炸,且易和氢氧化钠溶液反应生成氯化钠、次氯酸钠而导致制取的氢氧化钠不纯 a d
【解析】
(1)电解精制饱和食盐水的方法制取氯气、氢气、烧碱,反应的离子方程式为:2Cl-+H2O![]() 2OH-+H2
2OH-+H2![]() +Cl2
+Cl2![]() ;
;
(2)阳离子交换膜只能阳离子通过,阴离子和气体不能通过,用石墨作电极电解饱和氯化钠时,阳极上氯离子放电生成氯气,氯气不能通过阳离子交换膜而进入阴极,如果氯气进入阴极易和氢气混合产生爆炸,且易和氢氧化钠溶液反应生成氯化钠、次氯酸钠而导致制取的氢氧化钠不纯;
(3)电解槽中阴极是氢离子放电生成氢气,水电离平衡正向进行氢氧根离子浓度增大,生成氢氧化钠溶液,NaOH溶液的出口为d;Cl2在阳极,根据装置图分析可以知道精制饱和食盐水从阳极进入,即进口为a。


科目:高中化学 来源: 题型:
【题目】下列实验现象或图像信息不能充分说明相应的化学反应是放热反应的是( )
反应装置或图像 | 实验现象或图像信息 | |
A |
| 反应开始后,针筒活塞向右移动 |
B |
| 反应物总能量大于生成物总能量 |
C |
| 反应开始后,甲处液面低于乙处液面 |
D |
| 温度计的水银柱不断上升 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,某恒容容器中发生可逆反应3H2(g)+N2(g) ![]() 2NH3 (g) ,下列叙述中能说明反应已达平衡状态的是
2NH3 (g) ,下列叙述中能说明反应已达平衡状态的是
A. 反应混合气体的质量不再变化B. 某一时刻测得![]()
C. 反应容器内气体体积不再变化D. 当生成0.3 mol H2的同时消耗了0.1mol N2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学——选修2:化学与技术]聚合硫酸铁(PFS)是水处理中重要的絮凝剂,下图是以回收废铁屑为原料制备PFS的一种工艺流程。
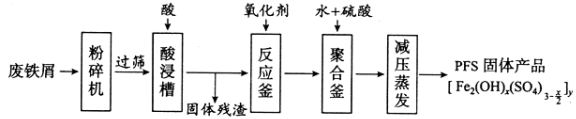
回答下列问题
(1)废铁屑主要为表面附有大量铁锈的铁,铁锈的主要成分为_________。粉碎过筛的目的是_______。
(2)酸浸时最合适的酸是_____,写出铁锈与酸反应的离子方程式_____________________。
(3)反应釜中加入氧化剂的作用是_________,下列氧化剂中最合适的是____________(填标号)。
a.KMnO4b.![]() c.
c.![]() d.
d.![]()
(4)聚合釜中溶液的pH必须控制在一定的范围内。pH偏小时Fe3+水解程度弱,pH偏大时则_______。
(5)相对于常压蒸发,减压蒸发的优点是______。
(6)盐基度B是衡量絮凝剂絮凝效果的重要指标,定义式为![]() (n为物质的量)。为测量样品的B值,取样品mg,准确加入过量盐酸,充分反应,再加入煮沸后冷却的蒸馏水,以酚酞为指示剂,用c
(n为物质的量)。为测量样品的B值,取样品mg,准确加入过量盐酸,充分反应,再加入煮沸后冷却的蒸馏水,以酚酞为指示剂,用c![]() 的标准NaOH溶液进行中和滴定(部分操作略去,已排除铁离子干扰)。到终点时消耗NaOH溶液V mL。按照上述步骤做空白对照试验,消耗NaOH溶液
的标准NaOH溶液进行中和滴定(部分操作略去,已排除铁离子干扰)。到终点时消耗NaOH溶液V mL。按照上述步骤做空白对照试验,消耗NaOH溶液![]() ,已知该样品中Fe的质量分数w,则B的表达式为__________。
,已知该样品中Fe的质量分数w,则B的表达式为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验兴趣小组利用下列实验装置探究氯气与过量氨气反应的实验,有关说法不正确的是
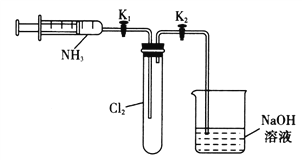
A. 打开K1,关闭K2,将注射器的活塞往外拉一小段,然后松开,活塞复原,说明装置气密性良好
B. 打开K1,推动注射器的活塞使过量的氨气与氯气混合时,产生大量的白色烟雾
C. 充分反应后,关闭K1,打开K2,可观察到烧杯中的溶液会倒吸至试管内
D. 实验室制备氨气和氯气可以用同一套发生装置
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素X、Y、Z、W在元素周期表中的相对位置如下图所示,其中W原子的质子数是其最外层电子数的三倍,下列说法不正确的是( )

A. 原子半径:W>Z>Y>X
B. 最高价氧化物对应水化物的酸性:X>W>Z
C. 最简单气态氢化物的热稳定性:Y>X>W>Z
D. 元素X、Z、W的最高化合价分别与其主族序数相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,将气体X和气体Y各0.4mol充入4L恒容密闭容器中,发生反应:X(g)+Y(g)![]() 2Z(g)ΔH<0。一段时间后达到平衡,反应过程中测定的数据如下表,下列说法不正确的是
2Z(g)ΔH<0。一段时间后达到平衡,反应过程中测定的数据如下表,下列说法不正确的是
t/min | 2 | 4 | 10 | 15 |
n(Y)/mol | 0.32 | 0.28 | 0.20 | 0.20 |
A.反应前4min平均速率v(X)=7.510-3mol·L-1·min-1
B.该温度下此反应的平衡常数:K=20
C.其他条件不变,降低温度,反应达到新平衡前:v(逆)<v(正)
D.保持其他条件不变,起始时向容器中充入0.8mol气体X和0.8mol气体Y,到达平衡时,Y的转化率为50%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中,正确的是( )
A.常温常压下,22gCO2中所含二氧化碳分子数约为6.02×1023
B.0.1molL-1NaOH溶液中含有0.1molNa+
C.0.5molCl2中含有的氯原子数约为6.02×1023
D.标准状况下,44.8L水的物质的量为2mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com