
 .反应I除生成两种正盐外,还有水生成,其化学方程式为COS+4NaOH=Na2S+Na2CO3+2H2O已知反应II的产物X的溶液中硫元素的主要存在形式为S2O32-,则II中主要反应的离子方程式为2S2-+5H2O=S2O32-+4H2↑+2OH-.
.反应I除生成两种正盐外,还有水生成,其化学方程式为COS+4NaOH=Na2S+Na2CO3+2H2O已知反应II的产物X的溶液中硫元素的主要存在形式为S2O32-,则II中主要反应的离子方程式为2S2-+5H2O=S2O32-+4H2↑+2OH-. 分析 (1)二氧化硅与碳高温下反应生成硅和一氧化碳;硅酸盐由盐的书写改写为氧化物的一般形式:碱性氧化物、两性氧化物、酸性氧化物、水;
(2)羰基硫分子与二氧化碳分子结构相似,均为直线型;反应I除生成两种正盐外,还有水生成,由元素守恒可知,生成正盐为Na2S、Na2CO3;II中主要反应硫化钠与水反应生成S2O32-、氢气和氢氧化钠,根据电子守恒和原子守恒书写.
解答 解:(1)二氧化硅与碳高温下反应生成硅和一氧化碳SiO2+2C$\frac{\underline{\;高温\;}}{\;}$Si+2CO↑;硅单质可用于芯片、半导体材料、太阳能电池等;由钠长石化学式NaAlSi3O8可推知钙长石的化学式为Ca(AlSi3O8)2,改写成氧化物的形式可表示为CaO.Al2O3.6SiO2,
故答案为:SiO2+2C$\frac{\underline{\;高温\;}}{\;}$Si+2CO↑;芯片、半导体材料、太阳能电池等;Ca(AlSi3O8)2;CaO.Al2O3.6SiO2;
(2)羰基硫分子与二氧化碳分子结构相似,均为直线型,其电子式为 ,反应I除生成两种正盐外,还有水生成,由元素守恒可知,生成正盐为Na2S、Na2CO3,反应为COS+4NaOH=Na2S+Na2CO3+2H2O,硫化钠与水反应生成S2O32-、氢气和氢氧化钠,其反应的离子方程式为:2S2-+5H2O=S2O32-+4H2↑+2OH-,
,反应I除生成两种正盐外,还有水生成,由元素守恒可知,生成正盐为Na2S、Na2CO3,反应为COS+4NaOH=Na2S+Na2CO3+2H2O,硫化钠与水反应生成S2O32-、氢气和氢氧化钠,其反应的离子方程式为:2S2-+5H2O=S2O32-+4H2↑+2OH-,
故答案为: ;OS+4NaOH=Na2S+Na2CO3+2H2O;2S2-+5H2O=S2O32-+4H2↑+2OH-.
;OS+4NaOH=Na2S+Na2CO3+2H2O;2S2-+5H2O=S2O32-+4H2↑+2OH-.
点评 本题考查较综合,涉及物质结构与性质、氧化还原反应计算、离子反应等,侧重反应原理中高频考点的考查,综合性较强,题目难度中等.


 开心蛙状元测试卷系列答案
开心蛙状元测试卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 流出溶液的体积为(m-n)mL | B. | 流出溶液的体积为(n-m)mL | ||
| C. | 管内溶液体积等于(a-n)mL | D. | 管内溶液体积多于nmL |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Mg2+、Al3+、F-、Ne | B. | Na+、F-、S2-、Ar | ||
| C. | K+、Ca2+、S2-、Ne | D. | Mg2+、Na+、Cl-、S2- |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
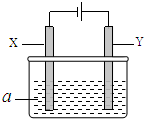 电解原理在化学工业中有广泛应用.如图表示一个电解池,其中a为电解质溶液,X、Y是两块电极板,通过导线与直流电源相连.
电解原理在化学工业中有广泛应用.如图表示一个电解池,其中a为电解质溶液,X、Y是两块电极板,通过导线与直流电源相连.| 方案 | X | Y | a溶液 |
| A | 银 | 石墨 | AgNO3 |
| B | 银 | 铁 | AgNO3 |
| C | 铁 | 银 | AgNO3 |
| D | 铁 | 银 | Fe(NO3)3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:2:l | B. | 2:2:1 | C. | 2:3:l | D. | 4:3:2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com