
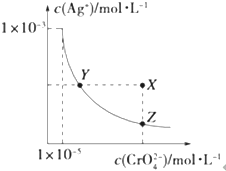
 在t℃时,Ag2CrO4(橘红色)在水溶液中的沉淀溶解平衡曲线如图所示.又知AgCl的Ksp=1.8×10-10.下列说法不正确的是( )
在t℃时,Ag2CrO4(橘红色)在水溶液中的沉淀溶解平衡曲线如图所示.又知AgCl的Ksp=1.8×10-10.下列说法不正确的是( )| A、t℃时,Ag2CrO4的Ksp为1×10-11 |
| B、饱和Ag2CrO4溶液中加入K2CrO4能使溶液由Y点变为X点 |
| C、t℃时,Y点和Z点时Ag2CrO4的Ksp相等 |
| D、t℃时,将0.01mol?L-1AgNO3溶液滴入20mL0.01mol?L-1KCl和0.01mol?L-1K2CrO4的混合溶液中,Cl-先沉淀 |
|
| 10 |
| 1.8×10-10 |
| 0.01 |


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
| A、加入AgNO3溶液,生成白色沉淀,再加入稀盐酸,沉淀不溶解,可确定有Cl-存在 |
| B、用洁净铂丝蘸取该溶液在火焰上灼烧,产生黄色火焰,则原溶液中一定含有Na+ |
| C、加入HCl溶液,生成无色无味气体,该气体能使澄清石灰水变浑浊,则原溶液中一定含有CO32- |
| D、加入Ba(NO3)2溶液,生成白色沉淀,加稀盐酸沉淀不溶解,可确定有SO42-存在 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 放电 |
| 充电 |
| A、放电时电解质溶液显强酸性 |
| B、充电时阳板反应为Ni(OH)2+2OH--2e-=NiO2+2H2O |
| C、放电时正极附近溶液pH减小 |
| D、充电时阴极附近溶液的碱性保持不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氯气可用于自来水的消毒,明矾或铁盐可用来净化水,可推知K2FeO4既能消毒又能净化水 |
| B、配置FeCl3溶液时为防止出现浑浊,应向溶液中加入盐酸抑制Fe3+的水解 |
| C、向纯水中加入盐酸或降温都能使电离平衡逆向移动,但水的离子积不变 |
| D、合成氨生产中将氨气液化分离,提高氢气的转化率 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示,其中Y原子的最外层电子数是其电子层数的3倍.下列说法正确的是( )
短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示,其中Y原子的最外层电子数是其电子层数的3倍.下列说法正确的是( )| A、元素Y和元素Z的最高正化合价相同 |
| B、单核阴离子半径的大小顺序为:r(W)>r(Y)>r(Z) |
| C、气态氢化物稳定性:X<Y<Z |
| D、元素W的最高价氧化物对应的水化物是强酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、NaNO3、NH3?H2O、N2 |
| B、Fe、CH3COOH、液氯 |
| C、漂白粉、BaSO4、CO2 |
| D、Ba(OH)2、HF、酒精 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com