
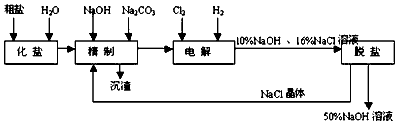
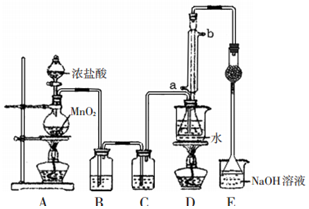
分析 由流程可知,粗盐加水化盐溶解后,加NaOH除去镁离子,加碳酸钠除去钙离子,精制后得到的沉渣为CaCO3、Mg(OH)2;精制后的食盐水电解生成NaOH、氢气、氯气,最后脱盐(NaCl等)得到高浓度的NaOH溶液,
(1)工业食盐中含有较多的Ca2+、Mg2+杂质,可以用试剂NaOH、Na2CO3除去反应为氯化钙和碳酸钠反应生成碳酸钙沉淀,氯化镁和氢氧化钠反应生成氢氧化镁沉淀;
(2)如果含有SO42-,则可加Ba2+形成BaSO4白色沉淀;由于不能引进其他阴离子,所以钡试剂只能用BaCl2或Ba(OH)2;为了有效除去Mg2+、Ca2+和SO42-,必须先加钡试剂或NaOH,最后加入Na2CO3溶液,如果先加入Na2CO3溶液,后加BaCl2或Ba(OH)2,则多余Ba2+无法除去;
(3)电解NaCl溶液时,在与电源正极相连的电极上(阳极),Cl-失去电子生成Cl2:2Cl--2e-=Cl2;在与电源负极相连的电极(阴极)发生的反应为:2H++2e-=H2,消耗H+,产生OH-,所以附近的pH上升;检验氯气通常使用湿润的碘化钾淀粉溶液;
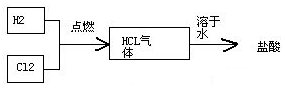
(4)氯气有毒,为保证氯气完全反应,氢气应过量,据此判断解答;氯化氢易溶于水,据此设计实验分析是否含量大于97%;
(5)氯气和氢氧化钠溶液反应生成氯化钠、次氯酸钠和水;
(6)物质的结构决定物质的性质,从微观上对比盐酸与氯化氢气体的构成,盐酸是氯化氢气体的水溶液,氯化氢溶于水后离解成自由移动的氢离子和氯离子,而构成水的基本粒子是水分子.所以,构成盐酸溶液的基本粒子是氢离子、氯离子和水分子,其中氢离子能使蓝色石蕊试纸变红,石蕊试纸有两种,蓝色石蕊试纸和红色石蕊试纸,蓝色石蕊试纸常用于测定酸性溶液,在酸性溶液中显红色;氯化氢气体是由氯化氢分子构成的,氯化氢既不属于酸也不属于碱,不能能使蓝色石蕊试纸变色进行解答.
解答 解:(1)工业食盐中含有较多的Ca2+、Mg2+杂质,可以用试剂NaOH、Na2CO3除去反应为氯化钙和碳酸钠反应生成碳酸钙沉淀,氯化镁和氢氧化钠反应生成氢氧化镁沉淀,所以化学方程式为CaCl2+Na2CO3→CaCO3↓+2NaCl,MgCl2+2NaOH=Mg(OH)2↓+2NaCl;
故答案为:CaCl2+Na2CO3=CaCO3↓+2NaCl; MgCl2+2NaOH→Mg(OH)2↓+2NaCl;
(2)除去粗盐中的SO42-,可加Ba2+形成BaSO4白色沉淀,由于不能引进其他阴离子,所以钡试剂只能用BaCl2或Ba(OH)2,故AC正确,
故答案为:AC;
(3)在电解过程中,与电源负极相连的电极为阴极,电解池中阴极氢离子得到电子生成氢气,电极反应式为:2H++2e-═H2↑;阳极氯离子失去电子生成氯气,2Cl--2e-=Cl2,电解过程中反应的化学方程式为:2NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$2NaOH+H2↑+Cl2↑,氯气能够使淀粉碘化钾溶液变蓝,可用湿润的淀粉碘化钾试纸检验氯气,现象是试纸变为蓝色,
故答案为:2NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$2NaOH+H2↑+Cl2↑; Cl2;湿润的碘化钾淀粉; 蓝;
(4)氯气有毒,为保证氯气完全反应,应该先通入氢气,再通入氯气,通入氯气前应先点燃氢气,氯化氢易溶于水,所以验证的方法是:取一个有刻度的玻璃瓶,收集一瓶合成气,倒放在水槽中,观察水面上升的高度,进行粗略估计,用100 mL刻度瓶收集满HCl气体,置于水中,水升至97 mL以上即认为符合要求,
故答案为:先通H2,再通Cl2;通H2点燃后再通Cl2;用100 mL刻度瓶收集满HCl气体,置于水中,水升至97 mL以上即认为符合要求;
(5)氯气和氢氧化钠溶液反应生成氯化钠、次氯酸钠和水,反应的化学方程式为:Cl2+2NaOH=NaCl+NaClO+H2O,
故答案为:Cl2+2NaOH=NaCl+NaClO+H2O;
(6)盐酸是一种酸,盐酸溶液中的氢离子能使蓝色石蕊试液变成红色,氯化氢既不属于酸也不属于碱,不能能使蓝色石蕊试纸变色,仍为蓝色;
盐酸能使蓝色石蕊试纸变红,盐酸是氯化氢气体的水溶液,氯化氢气体和水能不能使蓝色石蕊试纸变红呢?通过B试管中实验已经排除了单独的氯化氢气体不能使蓝色石蕊试纸变色,还需要进一步排除单独的水也不能使使蓝色石蕊试纸变色,要利用控制变量法向C试管中单独加入水进行试验,水的化学式为H2O.
故答案为:红;蓝;H2O;证明单独的氯化氢气体或水均不能使蓝色石蕊试纸变色.
点评 本题考查氯碱工业,题目难度中等,涉及电解原理、粗盐提纯、化学实验基本操作方法的应用、实验设计等知识,明确发生的离子反应及电解反应原理是解答的关键,注意除杂不能引入新的杂质及试剂的添加顺序和物质性质的分析应用.


 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案科目:高中化学 来源: 题型:选择题
| A. | 钠粒投入100mL稀盐酸中,溶液质量减轻 | |
| B. | 加热氧化钠和过氧化钠固体混合物,固体质量减轻 | |
| C. | 铁钉放入氯化铜溶液中,固体质量增大 | |
| D. | 光照新制氯水,溶液的颜色变浅,酸性减弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 S2Cl2是工业上常用的硫化剂,实验室利用反应:CS2+3Cl2=CCl4+S2Cl2来制备S2Cl2,反应装置如图所示(部分夹持装置省略).
S2Cl2是工业上常用的硫化剂,实验室利用反应:CS2+3Cl2=CCl4+S2Cl2来制备S2Cl2,反应装置如图所示(部分夹持装置省略).| 物质 | 沸点/℃ | 熔点/℃ |
| CS2 | 47 | -109 |
| CCl4 | 77 | -23 |
| S2Cl2 | 137 | -77 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只有②④⑥ | B. | 只有③④⑥ | C. | 只有①③⑤ | D. | 只有①②⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 纤维素与淀粉互为同分异构体 | |
| B. | 糖类、油脂、蛋白质都是高分子化合物,一定条件下均能水解 | |
| C. | 煤的气化、煤的液化和石油的分馏都是化学变化 | |
| D. | 葡萄糖和蔗糖都含有C、H、O三种元素,但不是同系物 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 ,下列说法正确的是( )
,下列说法正确的是( )| A. | M的同分异构体有3种(不考虑立体异构) | |
| B. | N分子中所有原子共平面 | |
| C. | Q的名称为异丙烷 | |
| D. | M、N、Q均能与Br2反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com