
| A. | 升高温度,固体的量减少 | |
| B. | 加入少量Na2CO3粉末能增大钙离子的浓度 | |
| C. | 降低温度,溶液中c(OH-)增大 | |
| D. | 恒温下加入少量CaO,溶液的pH增大 |
分析 对于反应Ca(OH)2(s)?Ca2+(aq)+2OH-(aq)△H<0,正反应为放热过程,升高温度,平衡逆向移动,结合离子浓度对平衡移动的影响解答该题.
解答 解:A.平衡状态下为饱和溶液,给溶液加热,Ca(OH)2的溶解度降低,固体量增多,故A错误;
B.加入少量Na2CO3粉末,Na2CO3溶液中碳酸根离子结合钙离子生成沉淀,OH-浓度增大,平衡向正反应方向移动,加入少量Na2CO3粉末不能增大钙离子的浓度,故B错误;
C.Ca(OH)2的溶解度随温度的升高而降低,降低温度,平衡正向进行溶液中的OH-浓度增多,故C正确;
D.恒温下向溶液中加入CaO,发生CaO+H2O=Ca(OH)2,仍为饱和溶液,c(OH-)不变,pH不变,故D错误.
故选C.
点评 本题综合考查难溶电解质的溶解平衡问题,为高频考点,侧重于饱和溶液特点以及溶解平衡移动的影响因素的考查,题目难度中等,注意A为易错点,Ca(OH)2的溶解度随温度的升高而降低.


 全程金卷系列答案
全程金卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 凭气味和颜色 | |
| B. | 通入AgNO3溶液 | |
| C. | 干燥的蓝色石蕊试纸,观察其颜色变化 | |
| D. | 紫色石蕊试液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 仅④⑤ | B. | 仅③④⑥ | C. | 仅⑥⑦ | D. | 仅①②⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
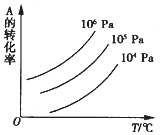 有一化学平衡mA(g)+nB(g)?pC(g)+qD(g),如图表示的是A的转化率与压强、温度的关系.下列正确的是( )
有一化学平衡mA(g)+nB(g)?pC(g)+qD(g),如图表示的是A的转化率与压强、温度的关系.下列正确的是( )| A. | △H<0;△S<0 | B. | △H>0;△S>0 | C. | △H<0;△S>0 | D. | △H>0;△S<0 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 变为原来的10-3倍 | B. | 变为 原来的10-2倍 | ||
| C. | 变为原来的103倍 | D. | 不发生变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 +
+ $?_{△}^{浓H_{2}SO_{4}}$
$?_{△}^{浓H_{2}SO_{4}}$ +H2O
+H2O| 相对分子质量 | 密度/(g•cm-3) | 沸点/℃ | 水中溶解性 | |
| 异戊醇 | 88 | 0.8123 | 131 | 微溶 |
| 乙酸 | 60 | 1.0492 | 118 | 溶 |
| 乙酸异戊酯 | 130 | 0.8670 | 142 | 难溶 |
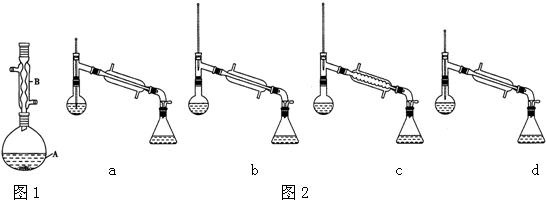
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
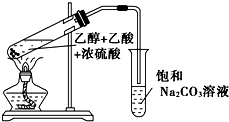 实验室制备乙酸乙酯,是将3mL乙醇加入一支试管中,然后边振荡试管,边慢慢加入2mL浓H2SO4和2mL乙酸,按如图连接好装置,在酒精灯上加热.观察现象.
实验室制备乙酸乙酯,是将3mL乙醇加入一支试管中,然后边振荡试管,边慢慢加入2mL浓H2SO4和2mL乙酸,按如图连接好装置,在酒精灯上加热.观察现象.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CaCO3(s)=CaO(s)+CO2(g)室温下不能自发进行,说明该反应的△H>0、△S<0 | |
| B. | 使用催化剂能够降低化学反应的反应热(△H) | |
| C. | 由Ka(HCN)<Ka(CH3COOH)可说明在相同条件下,氢氰酸的酸性比醋酸弱 | |
| D. | 化学平衡常数的大小与温度、浓度、压强有关,与催化剂无关 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.12 mol•L-1 | B. | 0.1 mol•L-1 | C. | 1.2 mol•L-1 | D. | 1.0 mol•L-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com