
【题目】现以CO、O2、熔融盐Z(Na2CO3)组成的燃料电池,采用电解法处理CO同时制备N2O5,装置如图所示,其中Y为CO2。下列说法不合理的是
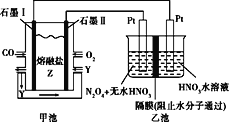
A.石墨Ⅰ是原电池的负极,发生氧化反应
B.甲池中的CO32-向石墨Ⅱ极移动
C.石墨Ⅰ的电极反应式:CO+CO32--2e-=2CO2
D.若甲池消耗标准状况下的氧气2.24L,则乙池中产生氢气0.2mol
科目:高中化学 来源: 题型:
【题目】关于反应过程中的先后顺序,下列评价正确的是
A.向浓度都为0.1mol/L的FeCl3和CuCl2加入铁粉,溶质CuCl2首先与铁粉反应
B.向过量的Ba(OH)2溶液中滴加少量的KAl(SO4)2溶液,开始没有白色沉淀生成
C.向浓度都为0.1mol/L 的Na2CO3和NaOH的混合溶液通入CO2气体,NaOH首先反应
D.向浓度为0.1mol/L的FeCl3溶液中,加入质量相同、颗粒大小相同的铁和铜,铜单质首先参加反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如表列出了A~R9种元素在周期表中的位置,用化学用语回答:
主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA |
|
2 | E | F | ||||||
3 | A | C | D | G | R | |||
4 | B | H |
(1)这九种元素中化学性质最不活泼的是___。
(2)D元素的最高价氧化物对应的水化物与氢氧化钠反应的离子方程式是__。
(3)A、B、C三种元素按原子半径由大到小的顺序排列为__。
(4)F、G、H三种元素简单氢化物沸点由高到低的顺序__。/p>
(5)E元素氧化物的电子式是__,F的氢化物在常温下跟B反应的化学方程式是__。
(6)下列事实能用元素周期律解释的是(填字母序号)__。
A.D的最高价氧化物对应水化物的碱性弱于Mg(OH)2
B.G的气态氢化物的稳定性弱于HF
C.FeG3的溶液可用于刻蚀铜制的印刷电路板
(7)G的单质可以从NaBr溶液中置换出Br2单质,从原子结构的角度解释其原因:_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验是化学研究的基础。关于下列各实验装置图的叙述中正确的是( )

A. 装置①常用于分离互不相溶的液态混合物
B. 装置②可用于吸收氨气,且能防止倒吸
C. 用装置③不可以完成“喷泉”实验
D. 用装置④稀释浓硫酸和铜反应冷却后的混合液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关实验装置进行的相应实验,能达到实验目的的是
A.利用图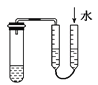 方法验证装置的气密性
方法验证装置的气密性
B.实验室里利用图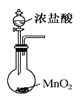 装置制备氯气
装置制备氯气
C.利用图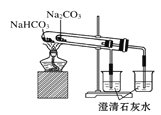 比较碳酸钠和碳酸氢钠的热稳定性
比较碳酸钠和碳酸氢钠的热稳定性
D.利用图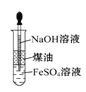 制备Fe(OH)2并能较长时间观察其颜色
制备Fe(OH)2并能较长时间观察其颜色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,配制一组c(PO43-)+c(HPO42-)+c(H2PO4-)+c(H3PO4)=0.100 mol·L-1的H3PO4和NaOH混合溶液,溶液中部分微粒的物质的量浓度随pH的变化曲线如图所示。下列指定溶液中微粒的物质的量浓度关系一定正确的是
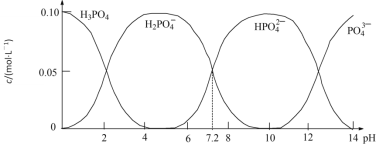
A.pH=6的溶液中:c(H3PO4)+c(HPO42-)>c(H2PO4-)
B.c(Na+)=0.100mol·L-1的溶液中:c(H3PO4)=2c(PO43-)+c(HPO42-)
C.pH =7的溶液中:c(Na+)>2c(HPO42-)+c(H2PO4-)
D.c(H3PO4)=c(H2PO4-)的溶液中:c(Na+)<0.100mol·L-1 +2c(PO43-)+c(HPO42-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)有一瓶无色澄清溶液,其中可能含H+、Na+、Mg2+、Ba2+、Cl、SO42、CO32离子。现进行以下实验:
A、用pH试纸检验溶液,发现溶液呈强酸性;
B、取部分溶液逐滴加入NaOH溶液,使溶液由酸性变为碱性,无沉淀产生;
C、取少量B中的碱性溶液,滴加Na2CO3溶液,有白色沉淀产生。
①根据上述事实确定:该溶液中肯定存在的离子有_________________________;
肯定不存在的离子有___________________________。
②写出C中发生反应的离子方程式________________________________。
(2)①还原铁粉与高温水蒸气反应的化学方程式:_____________________________;
②除去Mg粉中的Al粉的试剂是__________________,反应的离子方程式为:___________________________________;
(3)高铁酸钠(Na2FeO4)具有强氧化性,可对自来水进行消毒、净化。高铁酸钠可用氢氧化铁和次氯酸钠在碱性介质中反应得到,请补充并配平下面离子方程式。
____Fe(OH)3 +____ClO-+____OH- =__FeO42-+___Cl-+_____ _______
(4)在反应11P+15CuSO4+24H2O=5Cu3P+6H3PO4+15H2SO4中,氧化剂是___________;
当有2mol H3PO4生成,转移的电子的物质的量为__________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列叙述正确的是
A. 所含共价键数均为0.4NA的白磷(P4)和甲烷的物质的量相等
B. 1 mol Na与O2反应,生成Na2O和Na2O2的混合物共失去NA个电子
C. 1mol Na2O2固体中含有离子总数为4NA
D. 25℃时,pH=13的氢氧化钠溶液中约含有NA个氢氧根离子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素X、Y、Z、W的原子序数依次增大。在如图所示的物质转化关系中,p、q、m、n分别是元素W、X、Y、Z的气体单质,p和s均为有色气体,v的水溶液呈碱性。常温下,0.1mol·L-1t溶液与0.1mol·L1u溶液的pH均为1。下列说法不正确的是( )
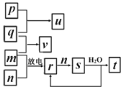
A.Y、W的最高价氧化物对应的水化物均为强酸
B.元素的非金属性:Z>Y>X,原子半径:X<Z<Y
C.s溶于水的反应中,氧化剂与还原剂的物质的量之比为1:2
D.v只有还原性,r既有还原性又有氧化性
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com