
| A. | 乙炔分子比例模型: | B. | 乙烯分子的结构简式为CH2CH2 | ||
| C. | 一氯甲烷的电子式为: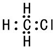 | D. | 2-甲基丁烷的键线式: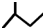 |
分析 A.乙炔是直线型分子,C、H原子处于同一直线上;
B.结构简式中需要标出官能团结构;
C.一氯甲烷的电子式中没有标出氯原子的3对孤电子对;
D.2-甲基丁烷的主链为丁烷,甲基在2号C原子.
解答 解:A.乙炔的官能团为碳碳双键,直线型结构,乙炔的比例模型为: ,故A错误;
,故A错误;
B.乙烯分子中含有碳碳双键,其正确的结构简式为:CH2=CH2,故B错误;
C.一氯甲烷中碳原子和氯原子最外层都达到8电子稳定结构,其正确的电子式为 ,故C错误;
,故C错误;
D.2-甲基丁烷中,主链为丁烷,在2号C上含有1个甲基,其键线式为: ,故D正确;
,故D正确;
故选D.
点评 本题考查了常见化学用语的表示方法判断,题目难度中等,涉及比例模型、电子式、结构简式、键线式等知识,明确常见化学用语的书写原则为解答关键,试题培养了学生的规范答题能力.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
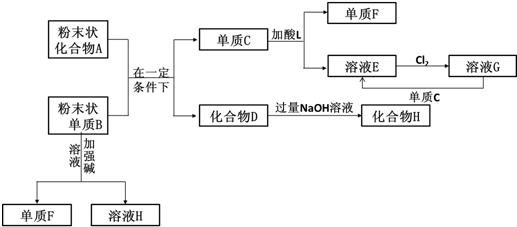
 已知A、B、C、D是中学化学的常见物质,且A、B、C均含有同一种元素.在一定条件下它们之间的相互转化关系如图所示(部分反应中的H2O已略去).
已知A、B、C、D是中学化学的常见物质,且A、B、C均含有同一种元素.在一定条件下它们之间的相互转化关系如图所示(部分反应中的H2O已略去).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ${\;}_{53}^{131}I$的化学性质与${\;}_{53}^{127}I$相同 | |
| B. | ${\;}_{53}^{131}I$的原子序数为53 | |
| C. | ${\;}_{53}^{131}I$的原子核外电子数为78 | |
| D. | ${\;}_{53}^{131}I$的原子核内中子与质子数之差为25 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向1mol•L-1的氨水中加少里硫酸铵固体,则溶液中$\frac{c(O{H}^{-})}{c(N{H}_{3}•{H}_{2}O)}$减小 | |
| B. | 物质的量浓度相等的①(NH4)2SO4溶液②NH4HCO3溶液③NH4Cl溶液④(NH4)2Fe(SO4)2溶液液中,c(NH${\;}_{4}^{+}$)的大小关系:④>①>③>② | |
| C. | 将2mol•L-1的某一元酸HA溶液和1mol•L-1 NaOH溶液等体积混合后溶液pH大于7,则反应后的混合液:c(OH-)+c(A-)=c(H+)+c(HA) | |
| D. | 物质的量浓度之比为 1:1 的NaClO、NaHCO3混合溶液中:c(HC10)+c(ClO-)=c(C0${\;}_{3}^{2-}$)+c(HCO${\;}_{3}^{-}$)+c(H2CO3) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
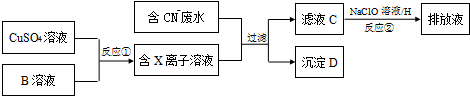
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com