
| A. | 外观澄清 | B. | 丁达尔效应 | ||
| C. | 胶体在一定条件下能稳定存在 | D. | 分散质粒子直径在1nm~100nm之间 |
 世纪百通主体课堂小学课时同步达标系列答案
世纪百通主体课堂小学课时同步达标系列答案 世纪百通优练测系列答案
世纪百通优练测系列答案科目:高中化学 来源: 题型:解答题
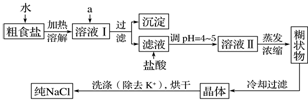
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 实验室将硫酸铜溶液直接加热蒸干来制取CuSO4•5H2O | |
| B. | 用湿润的pH试纸来测溶液的pH | |
| C. | 不慎将浓碱溶液沾到皮肤上,可先立即用稀盐酸中和,后用大量水冲洗,再涂上2%~5%的硼酸溶液 | |
| D. | 用四氯化碳萃取溴水中的溴 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1molOH-的质量是17g/mol | |
| B. | CO2的摩尔质量是44 | |
| C. | 标况下气体的摩尔体积是22.4L | |
| D. | 12gC-12中含的C原子数是阿伏伽德罗常数 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 60g C2H4O2所含共用电子对数目为7NA | |
| B. | 1L 0.1mol•L-1乙酸溶液中H+数为0.1NA | |
| C. | 1mol甲基或氨基所含电子数均为9NA | |
| D. | 标准状况下,22.4L乙醇的分子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
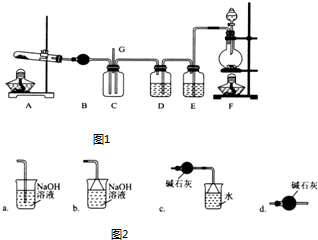
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com