
分析 (1)常温下,pH=7的溶液呈中性,则c(H+)=c(OH-),溶液中存在电荷守恒,根据电荷守恒判断c(NH4+)、c(Cl-)相对大小;
(2)若溶液的pH>7,则c(H+)<c(OH-),根据电荷守恒可知[NH4+]>[Cl-];
(3)碳酸氢钠溶液中碳酸氢根离子的水解程度大于电离程度,显示碱性;
(4)溶液②中存在物料守恒.n(Na)=n(C);
(5)取10mL溶液③,加水稀释到100mL,溶液浓度为原来的$\frac{1}{10}$,为0.01mol/L;
(6)根据AlCl3属于强酸弱碱盐,在溶液中存在水解平衡,氯化铝易水解生成氢氧化铝和HCl,升高温度HCl易挥发,蒸干溶液得到的固体是氢氧化铝,灼烧氢氧化铝,氢氧化铝分解生成氧化铝,所以最终得到的固体是氧化铝;
(7)硫酸铝和碳酸氢钠能发生双水解反应生成氢氧化铝沉淀和二氧化碳气体.
解答 解:(1)常温下,pH=7的溶液呈中性,则c(H+)=c(OH-),溶液中存在电荷守恒,根据电荷守恒得c(NH4+)+c(H+)=c(OH-)+c(Cl-),所以c(NH4+)=c(Cl-),
故答案为:=;
(2)若溶液的pH>7,如为碱性,则:c(H+)<c(OH-),根据电荷守恒c(NH4+)+c(H+)=c(OH-)+c(Cl-)可得:[NH4+]>[Cl-],
故答案为:>;
(3)碳酸氢钠溶液中碳酸氢根离子的水解程度大于电离程度,显示碱性,即c(Na+)>c(HCO3-)>c(OH-)>c(H+)>c(CO32-),故答案为:c(Na+)>c(HCO3-)>c(OH-)>c(H+)>c(CO32-);
(4)溶液②NaHCO3中存在物料守恒,溶液中碳元素所有存在形式浓度总和等于钠离子浓度,得到c(CO32-)+c(HCO3-)+c(H2CO3)=c(Na+)=0.1mol/L,
故答案为:0.1;
(5)取10mL溶液③,加水稀释到100mL,溶液浓度为原来的$\frac{1}{10}$,为0.01mol/L,由Kw=c(OH-)•c(H+)可知,c(OH-)=10-12 mol•L-1,则此时溶液中由水电离出的c(H+)=10-12 mol•L-1,
故答案为:10-12;
(6)氯化铝为强酸弱碱盐,Al3+发生水解,水解的方程式为Al3++3H2O?Al(OH)3+3H+,水解后溶液呈酸性,蒸干和灼烧过程中,HCl挥发,Al(OH)3不稳定,灼烧时分解生成Al2O3,
故答案为:Al2O3;
(7)硫酸铝和碳酸氢钠能发生双水解反应生成氢氧化铝沉淀和二氧化碳气体,离子方程式为Al3++3HCO3-=Al(OH)3↓+3CO2↑,
故答案为:Al3++3HCO3-=Al(OH)3↓+3CO2↑.
点评 本题考查了离子浓度大小比较、弱电解质的电离和盐类的水解等问题,题目难度中等,综合考查学生的化学知识应用能力和分析能力,题目难度中等.


科目:高中化学 来源: 题型:解答题
 已知酸性高锰酸钾溶液是常用的强氧化剂,可以和草酸钠、二氧化硫等还原性物质发生氧化还原反应.
已知酸性高锰酸钾溶液是常用的强氧化剂,可以和草酸钠、二氧化硫等还原性物质发生氧化还原反应.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 酸式滴定管未用待测溶液润洗 | |
| B. | 碱式滴定管未用待装溶液润洗 | |
| C. | 锥形瓶未用待装溶液润洗 | |
| D. | 在滴定前滴定管尖嘴部分有气泡,滴定后气泡消失 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在标准状况下,1L庚烷完全燃烧后,所生成的气态产物的分子数为$\frac{7}{22.4}$NA | |
| B. | 1mol碳正离子CH5+所含的电子数为10NA | |
| C. | 56g铁粉在1mol氯气中充分燃烧,失去的电子数为3NA | |
| D. | 0.5molC3H8分子中含C-H共价键2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 时间 | c(CO)/mol•L-1 | c(H2)/mol•L-1 | c(CH3OH)/mol•L-1 |
| 起始 | 1 | 3 | 0 |
| 第2min | 0.8 | 2.6 | 0.2 |
| 第4min | 0.4 | 1.8 | 0.6 |
| 第6min | 0.4 | 1.8 | 0.6 |
| A. | 第4 min至第6 min该化学反应处于平衡状态 | |
| B. | 第2 min时,如果只改变某一条件,则改变的条件可能加入了H2 | |
| C. | 第2 min时,如果只改变某一条件,则改变的条件可能是使用催化剂 | |
| D. | 第6 min时,其他条件不变,如果升高温度,正反应速率增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 已知X、Y元素同周期,且电负性X>Y,则第一电离能X大于Y | |
| B. | 分子中键能越大,键长越短,则分子越稳定,熔沸点越高 | |
| C. | N-H键键能的含义是拆开约6.02×1023个N-H键所吸收的能量 | |
| D. | H2O中每个O原子结合2个H原子的根本原因是共价键具有方向性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cl2通入水中:Cl2+H2O=2H++Cl-+ClO- | |
| B. | 铜丝插入稀硝酸:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O | |
| C. | 向NaClO溶液中通入过量SO2:ClO-+SO2+H2O=HClO+HSO3- | |
| D. | 向NaAlO2溶液中通入过量CO2:2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
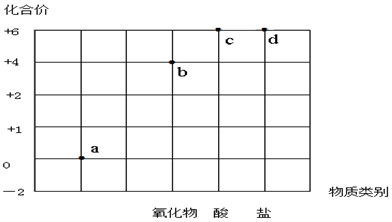
| A. | a点表示的物质所属的物质类别是单质 | |
| B. | b点表示的物质可以是SO2或SO3 | |
| C. | c点表示的化合物的浓溶液可作为干燥剂 | |
| D. | d点表示的可溶性物质能与BaCl2溶液发生反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com