
氨氧化法可制得50%的HNO3,加脱水剂可进一步制备90%HNO3。两种产品的质量比![]() =x(m1、m2分别为50%的HNO3的质量和90%的HNO3的质量),若以17t液氨为原料生产HNO3。
=x(m1、m2分别为50%的HNO3的质量和90%的HNO3的质量),若以17t液氨为原料生产HNO3。
(1)导出理论所需水量(y)与质量比(x)的关系式(假定NH3的转化率为100%);
(2)求出只生产50%的HNO3所需水的量和只生产90%HNO3所需水的量;
(3)质量比(x)为多少时,进出水的量保持平衡,此时两种产品的总质量为多少?
(1)![]()
(2)脱去水11t
(3)81t
本题联系化学工业生产实际,要求学生根据题目提供的条件进行有关硝酸工业上需水量的计算。化学试题与社会生产、生活、科技等的紧密结合与联系,对于学生在化学学习中坚持理论联系实际,学以致用,特别是摆脱封闭式的应试教育的藩蓠,实施开放式、多种形式的素质教育,充分拓宽自己的视野,提倡自主学习、自我研讨与探索,在自我获取知识的过程中提高自学能力和思维能力,有着十分重要的作用。(1)氨氧化法制硝酸的总的化学方程式为:NH3+2O2=HNO3+H2O,由此式可知:17t NH3可生成HNO363t、H2O 18t。根据题意,由HNO3量可建立等式:m1×50%+m2×90%=63……①
由H2O量可建立等式:y= m1×50%+m2×10%—18……②
联立①②结合m1/m2=x,即可得:![]() 。
。
(2)解法1:只生成50%的HNO3时,50%的HNO3中含水为63t,因反应生成水为18t,所以需水为63-18=45t;只生成90%的HNO3时,90%的HNO3中含水为![]() ,而反应生成水为18t,显然需脱去水18-7=11t。
,而反应生成水为18t,显然需脱去水18-7=11t。
解法2:根据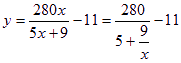 。只生成50%的HNO3时,m1/m2=x中x可视为非常大,则
。只生成50%的HNO3时,m1/m2=x中x可视为非常大,则![]() 可视为0,
可视为0,![]() ;只生成90%的HNO3时,m1/m2=x中x为0,则
;只生成90%的HNO3时,m1/m2=x中x为0,则![]() 可视为无穷大,
可视为无穷大,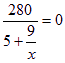 ,y=-11t,即需脱去11t水。
,y=-11t,即需脱去11t水。
(3)进出水平衡时,y=0。可得:![]() 。设两种产品的总质量为w,则有:
。设两种产品的总质量为w,则有:![]() 求得w=81t。
求得w=81t。


 应用题点拨系列答案
应用题点拨系列答案 状元及第系列答案
状元及第系列答案 同步奥数系列答案
同步奥数系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:038
氨氧化法可制得50%的硝酸,加脱水剂可进一步制备90%硝酸,两种产物的质量比![]() (
(![]() 分别为50%的硝酸溶液和90%的硝酸溶液质量),若以17t液氨为原料生产硝酸。
分别为50%的硝酸溶液和90%的硝酸溶液质量),若以17t液氨为原料生产硝酸。
(1)导出理论所需水量(yt)与质量比(x)的关系式(假定NH3的转化率为100%)。
(2)根据导出的关系式,求出只生产50%的硝酸所需水的质量和只生产90%的硝酸所需水的质量(t)。
(3)质量比(x)为多少时,进出水的质量保持平衡,此时两种产品的总质量为多少t?
查看答案和解析>>
科目:高中化学 来源:物理教研室 题型:038
(1)导出理论所需水量(yt)与质量比(x)的关系式(假定NH3的转化率为100%)。
(2)根据导出的关系式,求出只生产50%的硝酸所需水的质量和只生产90%的硝酸所需水的质量(t)。
(3)质量比(x)为多少时,进出水的质量保持平衡,此时两种产品的总质量为多少t?
查看答案和解析>>
科目:高中化学 来源:读想用 高二化学(上) 题型:038
某工厂用氨氧化法可制得质量分数为20%的硝酸,脱水后可进一步得到质量分数为90%的硝酸.若以17 t液氨为原料生产硝酸(假设反应及脱水过程中各反应物和生成物均无损耗)试回答下列问题.
(1)若该工厂同时生产质量分数分别为50%和90%的硝酸,它们的质量比为x=m1/m2(m1、m2分别为质量分数为50%的HNO3和90%的硝酸的质量).
①写出理论所需水量y与质量比x的函数关系式.
②当进出水量保持平衡时,x是多少,此时两种产品的总质量为多少吨.写出计算过程.
(2)若该工厂只生产质量分数为90%的HNO3,计算理论上需水的质量.
(3)若该工厂只生产质量分数为50%的HNO3,计算理论上需水的质量.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com