
【题目】化合物A 是一种重要的光化学试剂,属不含结晶水的盐.A~I 之间相互转化关系如下图所示: (部分反应物、生成物没有列出)
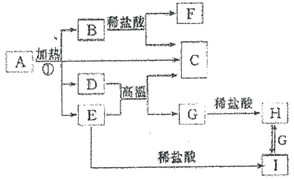
已知: A 中含两种阳离子和一种带二个单位负电荷的阴离子,三种离子的个数比为3:1:3。阴离子中各元素的质量分数与C相同且相对分子质量是C 的2倍。C、D 都为气体且含有元素种类相同,C 能使澄清石灰水变浑浊,E 是一种红棕色的颜料,F 的焰色反应呈紫色,I能使KSCN 溶液显红色。回答下列问题:
(1)A 的化学式________。
(2)①方程式________。
(3)D+E→C+G 的方程式________。
(4) H+H2O2+ H+→I 的离子反应方程式________。
(5)在A 的溶液中滴入酸性高锰酸钾溶液,高锰酸钾溶液紫色褪去;而在A 的溶液中滴入硫氰化钾溶液,溶液呈红色。产生上述现象的主要原因是________。
【答案】 K3Fe(C2O4)3 2 K3Fe(C2O4)3=Fe2O3+6CO↑+3CO2↑+3K2CO3 3CO+Fe2O3![]() 2Fe+3CO2 2Fe2++H2O2+2H+=2Fe3++2H2O 因为溶液中的草酸根被高锰酸钾氧化,故紫色褪去;滴加KSCN溶液,Fe3+与SCN-结合形成红色溶液
2Fe+3CO2 2Fe2++H2O2+2H+=2Fe3++2H2O 因为溶液中的草酸根被高锰酸钾氧化,故紫色褪去;滴加KSCN溶液,Fe3+与SCN-结合形成红色溶液
【解析】C能使澄清石灰水变浑,应为CO2,C、D都为气体且含有元素种类相同,则D为CO,E是一种红棕色的颜料,应为Fe2O3,F的焰色反应呈紫色,应含有K元素,为KCl,I为FeCl3,由转化关系可知H为FeCl2,则G为Fe, A 中阴离子中各元素的质量分数与C相同且式量是C的2倍,应为C2O42-,A中含二种阳离子和一种带二个单位负电荷的阴离子,三种离子的个数比为3:1:3,则A为K3Fe(C2O4)3,结合转化关系可知B为K2CO3。
(1)A 的化学式为:K3Fe(C2O4)3; (2)①反应是K3Fe(C2O4)3在加热条件下分解生成Fe2O3、CO、CO2、K2CO3,反应的化学方程式为:2 K3Fe(C2O4)3=Fe2O3+6CO↑+3CO2↑+3K2CO3;(3)D+E→C+G的方程式为:3CO+Fe2O3![]() 2Fe+3CO2;(4)H+H2O2+ H+→I 的离子反应方程式为:2Fe2++H2O2+2H+=2Fe3++2H2O;(5)A的溶液中中含有草酸根离子,可被酸性高锰酸钾氧化,且A中含有铁离子,可与KSCN发生显色反应,故答案为:因为溶液中的草酸根被高锰酸钾氧化,故紫色褪去;滴加KSCN溶液,Fe3+与SCN-结合形成红色溶液。
2Fe+3CO2;(4)H+H2O2+ H+→I 的离子反应方程式为:2Fe2++H2O2+2H+=2Fe3++2H2O;(5)A的溶液中中含有草酸根离子,可被酸性高锰酸钾氧化,且A中含有铁离子,可与KSCN发生显色反应,故答案为:因为溶液中的草酸根被高锰酸钾氧化,故紫色褪去;滴加KSCN溶液,Fe3+与SCN-结合形成红色溶液。


 小学数学口算题卡脱口而出系列答案
小学数学口算题卡脱口而出系列答案 优秀生应用题卡口算天天练系列答案
优秀生应用题卡口算天天练系列答案 浙江之星课时优化作业系列答案
浙江之星课时优化作业系列答案科目:高中化学 来源: 题型:
【题目】若NA表示阿伏加德罗常数的值,下列叙述中正确的是( )
A. 1mol Cl2参加化学反应,转移的电子数一定为2NA
B. 7.8g Na2O2 晶体中阴阳离子总数为0.4NA
C. 15.6 g Na2O2与过量CO2反应时,转移的电子数为0.2NA
D. 标准状况下,由0.5mol NO和0.5mol O2组成的混合气体,分子数约为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在某100mL混合溶液中,硝酸和硫酸的物质的量浓度分别为0.4mol/L和0.1mol/L,向该混合溶液中加入1.92克铜粉,加热待充分反应后,所得溶液中的Cu2+的物质的量浓度是________________ mol/L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将2.5gNaHCO3、Na2CO3、NaOH的固体混合物完全溶解于水,制成溶液,然后向该溶液中逐滴加入1mol/L的盐酸,所加盐酸的体积与产生CO2的体积(标准状况)关系如图所示,下列说法中错误的是
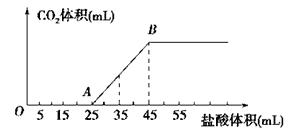
A. OA段发生反应的离子方程式为:OH-+H+==H2O H++CO32-==HCO3-
B. 当加入35mL盐酸时,产生CO2的体积为336mL
C. 混合物中NaOH的质量0.6g
D. A点溶液中的溶质为NaCl、NaHCO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】通常用碳在高温下还原二氧化硅制得粗硅,粗硅(合铁、铝、硼、磷等杂质)与氯气反应生成四氯化硅(反应温度450-500℃),四氧化硅经提纯后用氢气还原可得高纯硅。以下是实验室制备四氯化硅的装置示意图。(D的硬质玻璃管中盛装粗硅)

相关信息如下:a.四氧化硅遇水极易反应生成硅酸和氯化氢;
b.硼、铝、铁、磷在高温下均能与氯气直接反应生成相应的氯化物;
c.有关物质的物理常数见下表:
物质 | SiCl4 | BCl3 | AlCl3 | FeCl3 | PCl5 |
沸点/℃ | 57.7 | 12.8 | — | 315 | — |
熔点/℃ | -70.0 | -107.2 | — | — | — |
升华温度/℃ | — | — | 180 | 300 | 162 |
请回答下列问题:
(1)写出用碳在高温下还原二氧化硅制得粗硅的化学方程式_________________________。
(2)写出装置A中发生反应的离子方程式__________________________________。
(3)装置A中g管的作用是_________________;装置C中的试剂是____________;
(4)装置E中h瓶收集到的粗产物可通过多次蒸馏得到高纯度四氯化硅,蒸馏后的残留物中,除铁元素外可能还含有的杂质元素是________(填写元素符号)。
(5)写出尾气处理装置中发生反应的离子方程式___________________________。
(6)本题实验装置中有一明显的不足之处,请简述你的改进方案及理由: ___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某工厂的废金属屑的主要成分为Cu、Fe和Al,此外还含有少量Al2O3和Fe2O3,该厂用上述废金属屑制取新型高效水处理剂Na2FeO4(高铁酸钠)等产品,过程如下:
I.向废金属屑中加入过量的NaOH溶液,充分反应后过滤;
Ⅱ.向I所得固体中加入过量稀H2SO4,充分反应后过滤;
Ⅲ.向Ⅱ所得固体中继续加入热的稀H2SO4,同时不断鼓入空气,固体溶解得CuSO4溶液;
Ⅳ.……
(1)步骤I 中发生反应的化学方程式为___________、___________ 。
(2)步骤Ⅱ所得的滤液中加入KSCN溶液无明显现象,表明滤液中不存在Fe3+,用离子方程式解释其可能的原因: ___________ 。
(3)步骤Ⅲ获得CuSO4 溶液的离子方程式为___________ 。
(4)步骤II 所得滤液经进一步处理可制得Na2FeO4,流程如下:

①测得滤液中c(Fe2+)为a mol/L,若要处理1m3滤液,理论上需要消耗25%的H2O2溶液___________kg(用含a 的代数式表示)。
②写出由Fe(OH)3制取Na2FeO4的化学方程式: ___________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国政府为了消除碘缺乏病,规定在食盐中必须加入适量的碘酸钾。检验食盐中是否加碘,可利用如下反应:
KIO3+ KI+ H2SO4═ K2SO4+ I2 + H2O
(1)配平该方程式,并且用双线桥法表示该方程式电子转移的方向与数目:____________________
(2)该反应中氧化剂和还原剂的物质的量之比为______________;
(3)如果反应中转移0.5mol电子,则生成I2的物质的量为____________;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NaClO2是一种重要的杀菌消毒剂,也常用来漂白织物等,其一种生产工艺如下,回答下列问题:
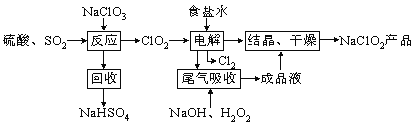
(1)ClO2的沸点为283K,纯ClO2易分解爆炸,一般用稀有气体或空气稀释到10%以下更安全。写出“反应”步骤中生成ClO2的化学方程式 。
(2)“尾气吸收”是吸收“电解”过程排出的少量ClO2。
①在尾气吸收过程中,可代替H2O2的试剂是 (填序号)。
A.Na2O2 B.Na2S C.FeCl2 D.KMnO4
②提高尾气的吸收效率的可行措施有 (填序号)。
A.尾气吸收时充分搅拌吸收液 B.适当加快尾气的通入速率
C.将温度控制在20℃以下 D.加水稀释尾气吸收液
③此吸收反应中,氧化剂与还原剂的物质的量之比为 。
(3)在碱性溶液中NaClO2比较稳定,在酸性溶液中,ClO2-和H+结合为HClO2,HClO2是唯一的亚卤酸,不稳定,易分解产生Cl2、ClO2和H2O,写出HClO2分解的化学方程式: 。
(4)已知NaClO2的溶解度随温度升高而增大,NaClO2饱和溶液在38℃以上60℃以下会析出NaClO2,在NaClO2析出过程中可能混有的杂质是 (填化学式)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com