
��10�֣�.��һ��������ܱ������м���2 mol A��0.6 mol C��һ������B�������塣һ�������·�����Ӧ�������ʵ���Ũ����ʱ��仯��ͼ������ʾ������t0--t1��c��B��δ������ͼ����Ϊt2ʱ�̺�ı䷴Ӧ��������ѧ��Ӧ������ʱ��仯 ��������ĸ��θı������������ͬ��ÿ����ֻ�ı�Ũ�ȡ�ѹǿ���¶ȡ������е�һ������������t3---t4��Ϊʹ�ô�����
��������ĸ��θı������������ͬ��ÿ����ֻ�ı�Ũ�ȡ�ѹǿ���¶ȡ������е�һ������������t3---t4��Ϊʹ�ô�����
��ش��������⣺
��1����t1="15" min����t0---t1����C���ʵ�Ũ�ȱ仯��ʾ�ķ�Ӧ����Ϊ mol��  L��1��min��1��
L��1��min��1��
��2��t4--t5�θı������Ϊ ��B����ʼ���ʵ���Ũ��Ϊ mol�� L��1��
��3��t5----t6�α����������¶Ȳ��䣬��A�����ʵ������仯��0.01mol�����˹����е���ЧӦΪa kJ������д�����¶��¸÷�Ӧ���Ȼ�ѧ����ʽ



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
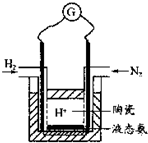 ��2012?�ɶ�ģ�⣩��һ��������ܱ������У��������»�ѧ��Ӧ��N2��g��+3H2��g��?2NH3��g����H��0
��2012?�ɶ�ģ�⣩��һ��������ܱ������У��������»�ѧ��Ӧ��N2��g��+3H2��g��?2NH3��g����H��0| t/�� | 25 | 125 | 225 | �� |
| K | 4.1��105 | K1 | K2 | �� |
| c2(NH3) |
| c3(H2)��c(N2) |
| c2(NH3) |
| c3(H2)��c(N2) |
| ʵ���� | �¶ȣ��棩 | ��ʼ����mol�� | ƽ������mol�� | �ﵽƽ������ʱ�䣨min�� | |
| N2 | H2 | NH3 | |||
| 1 | 650 | 2 | 4 | 0.9 | 9 |
| 2 | 900 | 1 | 2 | 0.3 | 0.01 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
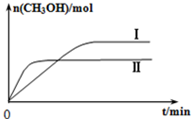 �о�CO2�����öԴٽ���̼���Ĺ���������Ҫ�����壮
�о�CO2�����öԴٽ���̼���Ĺ���������Ҫ�����壮| c(CH3OH)c(H2O) |
| c(CO2)c3(H2) |
| c(CH3OH)c(H2O) |
| c(CO2)c3(H2) |
| �� �� | �� | �� |
| ��Ӧ��Ͷ���� | 1molCO2��3molH2 | a molCO2��b molH2�� c molCH3OH��g����c molH2O��g�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
 2NH3��g��
2NH3��g��| t/K | 298 | 398 | 498 | �� |
| K/��mol?L-1��2 | 4.1��106 | K1 | K2 | �� |
 [N2H5?H2O]++H+
[N2H5?H2O]++H+ [N2H5?H2O]++H+
[N2H5?H2O]++H+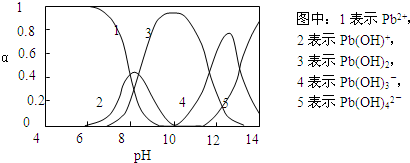
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| T/�� | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
| c(CO)c(H2O) |
| c(CO2)c(H2) |
| c(CO)c(H2O) |
| c(CO2)c(H2) |
| ʵ���� | a��H2�� | n��CO2�� | n��CO�� | n��H2O�� |
| A | 2 | 3 | 1 | 5 |
| B | 1 | 1 | 2 | 2 |
| C | 1.2 | 1.2 | 0.8 | 1.8 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��һ������SO2�ͺ�0.7mol�����Ŀ���������CO2������һ��������ܱ���
���У�������Ӧ��2SO2+O2 ![]() 2SO3������Ӧ���ȣ����ﵽƽ��������еĻ�
2SO3������Ӧ���ȣ����ﵽƽ��������еĻ�
������ͨ������NaOH��Һ���������������21.28 L���ٽ�ʣ������ͨ��ij��Һ����
O2�����������ּ�����5.6L���������������Ϊ��״���µ��������������������
һλС������ش��������⣺
��1���жϸ÷�Ӧ�ﵽƽ��״̬�ı�־��_______��������ĸ��
a��SO2��SO3Ũ����� b��SO2�ٷֺ������ֲ���
c�������������ѹǿ���� d��SO3������������SO2�������������
e�������л��������ܶȱ��ֲ���
��2�������SO2��ת���ʣ����д�ʩ���е���_______��������ĸ��
a����װ�����ٳ���N2 b����װ�����ٳ���O2
c���ı䷴Ӧ�Ĵ��� d�������¶�
��3����÷�Ӧ�ﵽƽ��ʱSO3��ת����_______���ðٷ�����ʾ����
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com