
【题目】下列说法中正确的是( )
①氢气在氯气中燃烧会发生爆炸 ②钠与硫酸铜溶液反应,可置换出铜 ③过氧化钠与水反应时可放出氧气④氯气与铁反应生成三氯化铁 ⑤钠、氢气都能在氯气中燃烧生成白雾 ⑥久置的氯水,因氯气几乎完全挥发掉,剩下的就是水
A. ③④ B. ①③⑤ C. ②④ D. ①④⑤
【答案】A
【解析】
①纯净的氢气在氯气中能安静的燃烧生成HCl ,故①说法不准确;②钠在硫酸铜溶液中发生的反应为:2Na+2H2O=2NaOH+H2↑,2NaOH+CuSO4 =Cu(OH)2↓+Na2SO4 ,不能置换出铜,故②说法错误;③过氧化钠与水反应:2Na2O2+2H2O=4NaOH+O2↑,故③正确;④氯气与铁反应:2Fe+3Cl2= 2FeCl3 ,故④正确;⑤钠在氯气中燃烧产生白烟,故⑤错误;⑥久置氯水中2HClO= 2HCl+O2↑,最后剩下的是稀盐酸,故⑥错误。故只有③④正确。
①纯净的氢气在氯气中能安静的燃烧生成HCl ,故①说法不准确;②钠在硫酸铜溶液中发生的反应为:2Na+2H2O=2NaOH+H2↑,2NaOH+CuSO4=Cu(OH)2↓+Na2SO4 ,不能置换出铜,故②说法错误;③过氧化钠与水反应:2Na2O2+2H2O=4NaOH+O2↑,故③正确;④氯气与铁反应:2Fe+3Cl2![]() 2FeCl3 ,故④正确;⑤钠在氯气中燃烧产生白烟,故⑤错误;⑥久置氯水中2HClO
2FeCl3 ,故④正确;⑤钠在氯气中燃烧产生白烟,故⑤错误;⑥久置氯水中2HClO ![]() 2HCl+O2↑,最后剩下的是稀盐酸,故⑥错误。故只有③④正确。A. ③④正确;B. ①③⑤不符合要求,故B错误;C. ②④不符合题意,故C错误; D. ①④⑤不符合题意,故D错误;本题答案为A。
2HCl+O2↑,最后剩下的是稀盐酸,故⑥错误。故只有③④正确。A. ③④正确;B. ①③⑤不符合要求,故B错误;C. ②④不符合题意,故C错误; D. ①④⑤不符合题意,故D错误;本题答案为A。


科目:高中化学 来源: 题型:
【题目】公元前,有一位厨师不小心把刚熬好的羊油碰翻在灶坑旁,与草木灰混在一起,当他将羊油与草木灰的混合物用手捧出去后,洗手时发现手洗得特别干净。对此下列解释正确的是( )
A. 羊油是一种有机溶剂,溶解了厨师手上的油污
B. 草木灰呈碱性,与羊油发生了中和反应,除去油污
C. 羊油与草木灰中的物质发生了加成反应,除去油污
D. 羊油在碱性草木灰(K2CO3)的作用下发生了皂化反应,生成具有去油污能力的物质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化硫分别通入下表所列溶液(装入试管)中至现象明显,如表实验报告记录的实验现象正确的是( )
石蕊试液 | 品红溶液 | 饱和硫化氢溶液 | 氯水 | |
A | 无色 | 无色 | 乳白色浑浊 | 无色 |
B | 红色 | 无色 | 黄色浑浊 | 无色 |
C | 红色 | 无色 | 乳白色浑浊 | 黄绿色 |
D | 无色 | 无色 | 乳白色浑浊 | 黄绿色 |
A.A
B.B
C.C
D.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化亚铜(CuCl)是一种白色粉末,不溶于水、乙醇(标准状况下沸点是78.2℃)及稀硫酸,熔点422℃,沸点1366℃,在空气中迅速被氧化成绿色,常用于有机合成工业中的催化剂。以粗盐水(含氯化钙、硫酸镁等杂质)、Cu、稀硫酸、SO2等为原料合成CuCl的工艺流程如下:
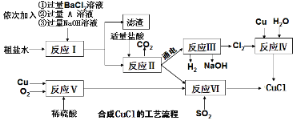
(1)A溶液中溶质的化学式是__________ ;
(2)写出反应V的化学方程式 _______________ ;
(3)反应VI的化学方程式是:2NaCl+2CuSO4+SO2+2H2O=2CuCl↓+2H2SO4+Na2SO4,反应中化合价升高的元素是___;
(4)本工艺中可循环利用的物质是NaOH和_____;
(5)反应VI后,过滤得到的CuCl沉淀,用无水乙醇洗涤沉淀,在真空干燥机内于70℃干燥2小时,冷却密封包装即得产品。真空干燥的目的是_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】草酸(乙二酸)存在于自然界的植物中,是一种弱酸。草酸的钠盐和钾盐易溶于水,而其钙盐难溶于水。草酸晶体(H2C2O4·2H2O)无色,熔点为101℃,易溶于水,受热易脱水、升华、170℃以上分解。回答下列问题:
(1)甲组同学按照如图所示的装置,通过实验检验草酸晶体的分解产物。装置A中试管口略向上倾斜的原因是__________;装置C中可观察到有气泡冒出,澄清石灰水变浑浊,由此可知草酸晶体分解的产物中有______;装置B的主要作用是______________________;

(2)乙组同学认为草酸晶体分解的产物中还可能含有CO,为进行验证,选用甲组实验中的装置A、B和如图所示的部分装置进行实验。

①乙组同学的实验装置中,依次连接的顺序为A、B、F、D、G、H、D、I,其中装置H中盛有的物质是_______;第一次使用装置D的作用是___________;
②能证明草酸晶体分解产物中有CO的现象是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性课题小组对氢氧化钠溶液和稀盐酸中和反应的有关问题,进行了如下探究:
I:(1)甲同学为了证明氢氧化钠溶液与稀盐酸能够发生反应,设计并完成了图 1所示实验,则 X溶液是_____________。
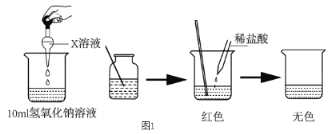
(2)乙同学用传感器探究稀 NaOH 溶液与稀盐酸反应过程中温度和 pH的变化。测定结果如图2所示。通过分析可知,稀 NaOH 溶液与稀盐酸反应会__________(放出”或“吸收”)热量。30s 时,溶液中的溶质为 _____________(写化学式)
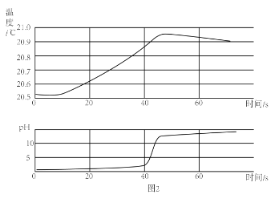
II:丙同学为了验证上述实验,也将盐酸滴入某氢氧化钠溶液中,发现有气泡产生,他认为该氢氧化钠溶液已经变质,变质原因用化学方程式可表示为 ____________________。
III:为了测定该氢氧化钠溶液中碳酸钠的质量分数,丙同学设计了如图3所示的实验装置。已知分液漏斗中装有 10%的稀盐酸,装置内试剂均足量。
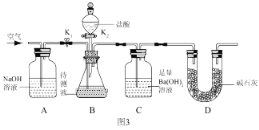
(实验步骤)
①按如图 3 连接好装置后,并检查装置气密性;
②关闭 K1 和 K2,向 B 装置中加入 100.0g该氢氧化钠溶液样品(忽略原装置内空气中CO2对实验的影响);
③打开 K2,向锥形瓶内滴加盐酸,直到 B 中不再产生气泡为止;
④打开 K1 关闭 K2,通入一段时间空气,至装置 C 中不再产生沉淀为止;
⑤将装置 C 中的固液混合物过滤、洗涤、烘干后称得固体质量为 5.0g。
(实验分析及数据处理)
①A 装置的作用是 ____________________。
②若缺少步骤④,则测定结果将 __________(填“偏大”、“偏小”或“不变”)。
③利用实验数据,计算该氢氧化钠溶液中碳酸钠的质量分数为 5.3%。
(实验反思)
下列各项措施中,能提高测定准确度的是 __________(填字母)
A.缓缓滴加稀盐酸
B.在装置 A、B 之间增加盛有浓硫酸的洗气瓶
C.在装置 B、C 之间增加盛有饱和 NaHCO3 的洗气瓶
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁酸钾(K2FeO4)是新型多功能水处理剂。其生产工艺如下:

回答下列问题:
(1)反应①应在温度较低的情况下进行,因温度较高时NaOH与Cl2反应生成NaClO3,写出温度较高时反应的离子方程式____________。
(2)在溶液I中加入NaOH固体的目的是_______(填字母)。
A.与反应液I中过量的Cl2继续反应,生成更多的NaClO
B.NaOH固体溶解时会放出较多的热量,有利于提高反应速率
C.为下一步反应提供碱性的环境
D.使NaClO3转化为NaClO
(3)反应的温度、原料的浓度和配比对高铁酸钾的产率都有影响。图1为不同的温度下,不同质量浓度的Fe(NO3)3对K2FeO4生成率的影响;图2为一定温度下,Fe(NO3)3质量浓度最佳时,NaClO浓度对K2FeO4的生成率的影响。

工业生产中最佳温度为_______,此时Fe(NO3)3与NaClO两种溶液的最佳质量浓度之比为_____。
(4)反应③中的离子反应方程式为_________________;溶液Ⅱ中加入饱和KOH得到湿产品的原因是__________________。
(5)高铁酸钾作为水处理剂是能与水反应其离子反应是:4FeO42-+l0H2O=4Fe(OH)3(胶体)十3O2↑+8OH-。则其作为水处理剂的原理是:①_______________;②_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用湿法炼锌产生的铜镉渣生产金属镉的流程如下:

已知:铜镉渣主要含锌、铜、铁、镉(Cd)、钴(Co)等单质。
下表列出了相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为0.1 mol·L-1计算):
氢氧化物 | Fe(OH)3 | Fe(OH)2 | Cd(OH)2 | Mn(OH)2 |
开始沉淀的pH | 1.5 | 6.5 | 7.2 | 8.2 |
沉淀完全的pH | 3.3 | 9.9 | 9.5 | 10.6 |
(1)为了提高铜镉渣浸出的速率,可采取的措施有:①适当升高温度;②搅拌;③______等。已知浸出的金属离子均为二价,写出浸出钴的化学方程式__________________。
(2)除钴的过程中,需要加入活化剂Sb2O3,锌粉会与Sb2O3、Co2+的溶液形成微电池并产生合金CoSb。该微电池的正极反应式为________________________________。
(3)除铁的过程分两步进行:
①先加入适量KMnO4,发生反应的离子方程式为______________________________,
②再加入ZnO控制反应液的pH范围为_____________。
(4)除铁过程第①步,若加入KMnO4时条件控制不当,MnO2会继续反应,造成的结果是______________,若加入的KMnO4不足量,则待电解溶液中有Fe元素残余。请设计实验方案加以验证_________________。
(5)净化后的溶液用惰性电极电解可获得镉单质。电解废液中可循环利用的溶质是____。
(6)处理含镉废水常用化学沉淀法,以下是几种镉的难溶化合物的溶度积常数(25℃):
Ksp(CdCO3)=5.210-12, Ksp(CdS)=3.610-29,Ksp(Cd(OH)2)=2.010-16,根据上述信息:
沉淀Cd2+效果最佳的试剂是____________。
a.Na2CO3 b.Na2S c.CaO
若采用生石灰处理含镉废水最佳pH为11,此时溶液中c(Cd2+)=_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为制取硝酸铜,某同学设计了如下四种方法:①铜与浓硝酸反应制取硝酸铜;②铜与稀硝酸反应制取硝酸铜;③铜先与空气反应制取氧化铜,再与硝酸反应制取硝酸铜;④铜与硝酸银溶液反应制取硝酸铜。
(1)方法②中被氧化的铜与被还原的硝酸的物质的量之比是 。
(2)“绿色化学”是当今社会提出的一个新概念。在“绿色化学”工艺中,杜绝污染源,提高原子利用率是绿色化学的重要衡量指标。请从“绿色化学”和经济效益角度考虑,大量制取硝酸铜宜采用上述第 (填序号)种方法,原因是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com