
【题目】下列物质不能使酸性高锰酸钾溶液褪色的是( )
A.聚乙烯B.二氧化硫C.乙醇D.异丙苯
科目:高中化学 来源: 题型:
【题目】【吉林大学附属中学2017届第八次模拟考试】麻黄素是中枢神经兴奋剂,其合成路线如图所示。NBS是一种选择性溴代试剂。

已知:![]()
(1)其中A为烃,相对分子质量为92,A的结构简式是________________;
E中官能团的名称为___________________。
(2)反应B→C的反应条件和试剂是_______________,⑤的反应类型是________。
(3)F的结构简式是____________________________。
(4)写出C→D的化学方程式______________________________________。
(5)化合物F的芳香族同分异构体有多种,M和N是其中的两类,它们的结构和性质如下:
①已知M遇FeCl3溶液发生显色反应,能和银氨溶液发生银镜反应,苯环上只有两个对位取代基,则M的结构简式可能为___________________________________。
②已知N分子中含有甲基,能发生水解反应,苯环上只有一个取代基,则N的结构有_____种。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示(B中冷却装置未画出),将氯气和空气(不参与反应)以体积比约1∶3混合通入含水8%的碳酸钠中制备Cl2O,并用水吸收Cl2O制备次氯酸溶液。
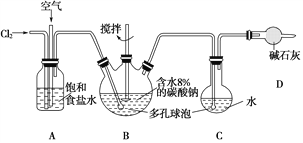
已知:Cl2O极易溶于水并与水反应生成HClO;Cl2O的沸点为3.8℃,42℃以上分解为Cl2和O2。
(1)①实验中控制氯气与空气的体积比的方法是___________________________________。
②使用多孔球泡的作用是_____________________________________。
(2)①装置B中产生Cl2O的化学方程式为____________________________________。
②若B无冷却装置,进入C中的Cl2O会大量减少。其原因是___________________________。
(3)装置C中采用棕色圆底烧瓶是因为________________________________。
(4)已知次氯酸可被H2O2、FeCl2等物质还原成Cl-。测定C中所得次氯酸溶液的物质的量浓度的实验方案:用_________量取20.00 mL次氯酸溶液于烧杯中,_____________________________。(可选用的试剂:H2O2溶液、FeCl2溶液、AgNO3溶液。除常用仪器外须使用的仪器有:电子天平,真空干燥箱)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学欲配制80mL2.0mol/LNaOH溶液,其转移溶液的操作如图所示。
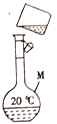
(1)图中操作上的错误是________。
(2)图中用到的仪器M是_______(填仪器名称和规格),下列关于仪器M的使用方法中,正确的是_______ (填字母)。
a.使用前应检查是否漏液 b.使用前必须烘干
c.不能用作物质反应或溶解的容器 d.可直接将热溶液转移到其中
(3)该同学称取NaOH固体的质量为________。
(4)下列操作会使配制的溶液浓度偏高的是______(填字母)。
a.所用过的烧杯未洗涤
b.转移过程中有少量溶液溅出
c.摇匀后,液面下降,再加入水至刻度线
d.定容时俯视刻度线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电负性是元素原子的重要性质,研究电负性的大小及其变化规律具有重要的价值。下列几种叙述中不属于电负性的应用的是( )
A. 判断一种元素是金属还是非金属
B. 判断化合物中元素化合价的正负
C. 判断化学键的类型
D. 判断化合物的溶解度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乌洛托品在合成、医药、染料等工业中有广泛用途,其结构式如图所示。将甲醛水溶液与氨水混合蒸发可制得乌洛托品。若原料完全反应生成乌洛托品,则甲醛与氨的物质的量之比为( )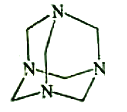
A. 1:1 B. 2:3 C. 3:2 D. 2:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[2017北京]某小组在验证反应“Fe+2Ag+=Fe2++2Ag”的实验中检测到Fe3+,发现和探究过程如下。
向硝酸酸化的0.05 mol·L-1硝酸银溶液(pH≈2)中加入过量铁粉,搅拌后静置,烧杯底部有黑色固体,溶液呈黄色。
(1)检验产物
①取出少量黑色固体,洗涤后,_______(填操作和现象),证明黑色固体中含有Ag。
②取上层清液,滴加K3[Fe(CN)6]溶液,产生蓝色沉淀,说明溶液中含有_______________。
(2)针对“溶液呈黄色”,甲认为溶液中有Fe3+,乙认为铁粉过量时不可能有Fe3+,乙依据的原理是___________________(用离子方程式表示)。针对两种观点继续实验:
①取上层清液,滴加KSCN溶液,溶液变红,证实了甲的猜测。同时发现有白色沉淀产生,且溶液颜色深浅、沉淀量多少与取样时间有关,对比实验记录如下:
序号 | 取样时间/min | 现象 |
ⅰ | 3 | 产生大量白色沉淀;溶液呈红色 |
ⅱ | 30 | 产生白色沉淀;较3 min时量少;溶液红色较3 min时加深 |
ⅲ | 120 | 产生白色沉淀;较30 min时量少;溶液红色较30 min时变浅 |
(资料:Ag+与SCN-生成白色沉淀AgSCN)
② 对Fe3+产生的原因作出如下假设:
假设a:可能是铁粉表面有氧化层,能产生Fe3+;
假设b:空气中存在O2,由于________(用离子方程式表示),可产生Fe3+;
假设c:酸性溶液中![]() 具有氧化性,可产生Fe3+;
具有氧化性,可产生Fe3+;
假设d:根据_______现象,判断溶液中存在Ag+,可产生Fe3+。
③ 下列实验Ⅰ可证实假设a、b、c不是产生Fe3+的主要原因。实验Ⅱ可证实假设d成立。
实验Ⅰ:向硝酸酸化的________溶液(pH≈2)中加入过量铁粉,搅拌后静置,不同时间取上层清液滴加KSCN溶液,3 min时溶液呈浅红色,30 min后溶液几乎无色。
实验Ⅱ:装置如图。其中甲溶液是________,操作及现象是________________。

(3)根据实验现象,结合方程式推测实验ⅰ~ⅲ中Fe3+浓度变化的原因:______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏德罗常数,下列叙述正确的是( )
A. 1mol NH4+含有的电子数目为11NA
B. 常温常压下,1.38g K2CO3含有的K+离子数为0.02NA
C. 标准状况下,11.2L CCl4含有的分子数为0.5NA
D. 100 mL 0.1 mol/LCH3COOH溶液中含有的H+离子数为0.01NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将0.1 mol的镁、铝混合物溶于100 mL 2mol/L H2SO4溶液中,然后再滴加1 mol/L NaOH溶液。请回答:
(1)若在滴加NaOH溶液的过程中,沉淀质量m随加入NaOH溶液的体积V变化如下图所示。

当V1=160mL时,则金属粉末中n(Mg)=________ mol,V2=_____________mL。
(2)若在滴加NaOH溶液过程中,欲使Mg2+、Al3+刚好沉淀完全,则滴入NaOH溶液的体积V(NaOH) _____________mL。
(3)若混合物仍为0.1 mol,其中Mg粉的物质的量分数为a,用100 mL 2 mol/L的硫酸溶解此混合物后,再加入450 mL 1mol/L的NaOH溶液,所得沉淀中无Al(OH)3。满足此条件的a的取值范围是:_____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com