
【题目】【化学—选修5:有机化学基础】有机物M按下图反应流程可合成两种高分子化合物。
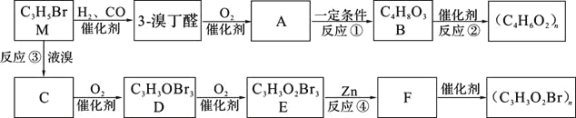

已知:D能发生银镜反应。M的核磁共振氢谱如图。完成下列填空:
(1)有机物M的名称是 (系统命名法),B中官能团的名称是 。
(2)F的结构简式为 ,反应①的类型是 。
(3)写出反应②的化学方程式 。
(4)反应③④的目的是 。
(5)写出满足下列条件的B的同分异构体的结构简式 。
①分子中含有“—COO—”和“—OH”、②只有三类氢原子、③分子中不含“—O—O—”
(6)设计一条由乙烯制得二丙酸乙二酯的合成路线,其他无机试剂任选。
(合成路线常用的表示方式为:![]() )
)
【答案】(1)2-溴-1-丙烯(1分);羟基、羧基(2分);
(2)HOOCCBr=CH2(1分);取代(水解)反应(1分);
(3)![]() (2分);
(2分);
(4)防止碳碳双键被氧化(2分);
(5)(CH3)2C(OH)COOH、HOOCOCH(CH3)2、HCOOC(CH3)2OH(3分);
(6) (3分)
(3分)
【解析】试题分析:D能发生银镜反应,说明和醛基。根据M的结构简式和M的核磁共振氢谱图可知M的结构简式为CH2=CBrCH3,因此C的结构简式为CH2BrCBr2CH3,D的结构简式为CH2BrCBr2CHO,D氧化生成E,则E的结构简式为CH2BrCBr2COOH。根据F生成的高聚物分子式可知E生成F是消去反应,则F的结构简式为CH2=CBrCOOH。3-溴丁醛氧化生成A,则A的结构简式为BrCH2CH2CH2COOH,A发生水解反应生成B,则B的结构简式为HOCH2CH2CH2COOH,B发生缩聚反应生成高分子化合物。
(1)根据以上分析可知有机物M的名称是2-溴-1-丙烯,B中官能团的名称是羟基和羧基。
(2)根据以上分析可知F的结构简式为CH2=CBrCOOH,反应①是溴原子被羟基取代,属于水解反应;
(3)根据以上分析可知反应②的化学方程式为
![]() 。
。
(4)根据以上分析可知反应③④的目的是防止碳碳双键被氧化。
(5)①分子中含有“—COO—”和“—OH”、②只有三类氢原子、③分子中不含“—O—O—”,因此满足条件的有机物结构简式为(CH3)2C(OH)COOH、HOOCOCH(CH3)2、HCOOC(CH3)2OH;
(6)根据已知信息结合逆推法可知由乙烯制得二丙酸乙二酯的合成路线可设计为
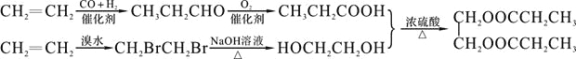 。
。


科目:高中化学 来源: 题型:
【题目】下列有关化学用语表示正确的是( )
A.中子数为10的氧原子:![]() B.Mg2+的结构示意图:
B.Mg2+的结构示意图:![]()
C.硫化钠的电子式:![]() D.甲酸甲酯的结构简式:C2H4O2
D.甲酸甲酯的结构简式:C2H4O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于酸碱中和滴定的说法中正确的是
A. 一般用石蕊试液作中和滴定的指示剂 B. 滴定时应控制滴加速率:先快后慢
C. 标准液浓度越大,滴定误差越小 D. 滴定时,眼睛注视滴定管内液面的变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中不正确的是 ( )
A. 淀粉、纤维素、蔗糖水解的最终产物都相同
B. 相同条件下的沸点顺序:戊烷>丁烷>丙烷
C. 乙烯和苯分子中所有原子均处于同一平面
D. 乙醇能被酸性高锰酸钾溶液直接氧化成乙酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲~辛等元素在周期表中的相对位置如下表。甲和戊的原子序数相差3,戊的一种单质是自然界硬度最大的物质。下列判断正确的是
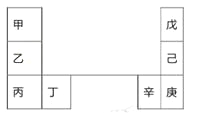
A. 金属性:甲>乙>丁
B. 原子半径:辛>己>戊
C. 丙和庚的原子核外电子数相差11
D. 乙的单质在空气中燃烧生成只含离子键的化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某氯化镁溶液的密度为1.18 g/cm,其中镁离子的质量分数为5.1%。300 mL该溶液中Cl-的物质的量约为( )
A.0.37 mol B.0.63 mol C.0.74 mol D.1.5 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于纯净物、混合物、电解质、非电解质的正确组合为( )
纯净物 | 混合物[来源 | 电解质 | 非电解质 | |
A | 盐酸 | 冰水混合物 | 硫酸 | 干冰 |
B | 蒸馏水 | 蔗糖溶液 | 氧化铝 | 二氧化硫 |
C | 胆矾 | 盐酸 | 铁 | 碳酸钙 |
D | 胆矾 | 食盐水 | 氯化铜 | 碳酸钠 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(2017安徽合肥期末)X、Y、Z、W、R是短周期元素,原子序数依次增大。X原子核外各层电子数之比为1∶2,Y原子和Z原子的核外电子数之和为20,W和R是同周期相邻元素,Y的氧化物和R的氧化物均能形成酸雨。请回答下列问题:
(1) 元素X的最高价氧化物的电子式为________;元素Z的离子结构示意图为________。
(2) 单质铜和元素Y的最高价氧化物对应水化物的稀溶液发生反应的化学方程式为________________。
(3) 元素W位于周期表的第________族,其非金属性比R弱,用原子结构的知识解释原因:_____________________________。
(4) R的一种氧化物能使品红溶液褪色,工业上用Y的气态氢化物的水溶液作该氧化物的吸收剂,写出吸收剂与足量该氧化物反应的离子方程式:________________________________。
(5) Y和Z组成的化合物ZY,被大量用于制造电子元件。工业上用Z的氧化物、X单质和Y单质在高温下制备ZY,其中Z的氧化物和X单质的物质的量之比为1∶3,则该反应的化学方程式为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,向aL的密闭容器中加入2molNO2(g), 发生如下反应:2NO2 ![]() 2NO + O2, 此反应达到平衡状态的标志是( )
2NO + O2, 此反应达到平衡状态的标志是( )
A. 单位时间内生成2n molNO同时生成2n molNO2
B. 单位时间内生成2n molNO同时生成n molO2
C. 混合气体中NO2、NO和O2的物质的量之比为2﹕2﹕1
D. 混合气体中NO2体积分数为50%
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com