
【题目】普通锌锰电池筒内无机物主要成分为MnO2、NH4Cl、ZnCl2等。某研究小组探究废于电池内的黑色固体并回收利用时,进行如图所示实验。下列有关实验的叙述正确的是

A. 操作①中玻璃棒的作用是转移固体 B. 操作②为过滤,得到的滤液显碱性
C. 操作③中盛放药品的仪器是坩埚 D. 操作④的目的是除去滤渣中的杂质
科目:高中化学 来源: 题型:
【题目】请按要求,回答下列问题:
(1)相同物质的量的SO2和SO3,所含O的质量之比为________。
(2)标准状况下,4.48 L 的NH3中,所含H的数目约为________。
(3)标准状况下,1 mol H2O、11.2 L CH 4、8 g O2中,体积最小的是________。
(4)某气体的质量为3.4 g,含有6.02×1022个分子,则该气体的摩尔质量为________。
(5)10 mL 0.5 mol·L-1 Al (NO3)3 溶液中NO3-的物质的量浓度为________。
(6)标准状况下,89.6 L HCl 气体溶于1 L水(ρ = 1 g·mL-1)中,所得盐酸的密度为1.146 g·mL-1,则此盐酸的物质的量浓度为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有一定量含有Na2O杂质的Na2O2试样,用下图的实验装置测定Na2O2试样的纯度。(可供选用的反应物只有CaCO3固体、6 mol·L-1盐酸、6 mol·L-1硫酸和蒸馏水)。
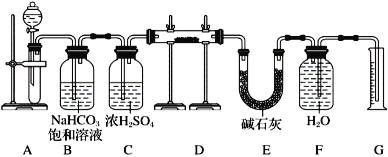
回答下列问题:
(1)连接好装置后需要进行的一步操作是:______,装置C的作用是________,装置E的作用是:____________。
(2)装置D中发生反应的化学方程式是__________、__________。
(3)若开始时测得样品的质量为2.2 g,反应结束后测得气体体积为224 mL(标准状况),则Na2O2试样的纯度为______。(保留一位小数点)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钪(Sc)及其化合物在电子、宇航、超导等方面有着广泛的应用。某工厂的钛白水解工业废酸中,Sc3+浓度为18mg/L,还含有大量的TiO2+、Fe3+、H+、SO42-等。下图为从该工业废酸中提取Sc2O3的一种流程。

回答下列问题:
(1)在钛白水解工业废酸中,加入双氧水是为了使TiO2+转化为难萃取的[Ti(O2)(OH(H2O)4]+。[Ti(O2)(OH(H2O)4]+中Ti的化合价为+4,其中非极性键的数目为_______。
(2)钪的萃取率(E%)与O/A值[萃取剂体积(O)和废酸液体积(A)之比]的关系如左下图,应选择的最佳O/A值为_______;温度对钪、钛的萃取率影响情况见右下表,合适的萃取温度为10-15℃,其理由是_____________________。

(3)洗涤“油相“可除去大量的钛离子。洗染水是用浓硫酸、双氧水和水按一定比例混合而成。混合过程的实验操作为________________。
(4)25℃时,用氨水调节滤液的pH,当pH=3.5时,滤渣II的主要成分是_______;当pH=6时,滤液中Sc3+的浓度为________。(Ksp[Fe(OH)3]=2.6×10-39,Ksp[Sc(OH)3]=9.0×10-31)
(5)写出用草酸(H2C2O4)“沉钪”得到Sc2(C2O4)3的离子方程式_____________。
(6)若从1m3该工厂的钛白水解度酸中提取得到24.4gSc2O3,则钪的提取率为______(保留三位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列四个数据是在不同条件下测出的合成氨反应的速率,其中最快的是
A. v(H2)=0.lmol /(L·min)
B. v(N2) =0.1mol /(L·min)
C. v(NH3)=0.15mol / (L·min)
D. v (N2)=0.02mol /(L·s)
查看答案和解析>>
科目:高中化学 来源: 题型:
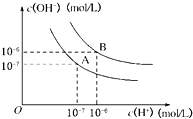
【题目】水的电离平衡曲线如图所示:
(1)若A点、B点分别表示25℃和100℃时水的电离平衡时离子的浓度,则表示25℃的是______(填“A”或“B”),100℃时水的离子积为__________。
(2)100℃,将pH=9的NaOH溶液与pH=4的盐酸溶液混合,若所得混合溶液pH=7,则NaOH溶液与盐酸溶液的体积比为_____。
(3)氧化还原滴定实验同中和滴定类似(用已知浓度的氧化剂溶液滴定未知浓度的还原剂溶液或反之)。现有0.001mol/L酸性KMnO4和未知浓度的无色NaHSO3溶液,反应离子方程式是2MnO4-+ 5HSO3- + H+=2Mn2+ + 5SO42- + 3H2O 填空回答问题:

①滴定时,将酸性KMnO4标准液装在图中的___________ (填“甲”或“乙”) 滴定管中。
②本实验___________ (填“需要”或“不需要”)指示剂。
③下列操作会使测定结果偏高的是_____
A.锥形瓶洗净后还留有蒸馏水
B.部分KMnO4溶液滴到锥形瓶外
C.盛装KMnO4溶液的滴定管滴定前读数正确,滴定后仰视读数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】超导材料为具有零电阻及磁性的物质,以Y2O3、BaCO3和CuO为原料,经研磨烧结可合成一种高温超导物质YBa2Cu3Ox。现欲合成0.5 mol此高温超导物,依化学计量数比例需取Y2O3、BaCO3和CuO的物质的量分别为( )
A. 0.50 mol、0.50 mol、0.50 mol B. 0.25 mol、1.0 mol、1.5 mol
C. 0.50 mol、1.0 mol、1.5 mol D. 1.0 mol、0.25 mol、0.17 mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com