
����Ŀ�������ü�������NO2��Ⱦ�����о���CH4+2NO2![]() N2+CO2+2H2O����1L�ܱ������У����Ʋ�ͬ�¶ȣ��ֱ����0.50molCH4��1.2molNO2�����n(CH4)��ʱ��仯���й�ʵ�����ݼ��±���
N2+CO2+2H2O����1L�ܱ������У����Ʋ�ͬ�¶ȣ��ֱ����0.50molCH4��1.2molNO2�����n(CH4)��ʱ��仯���й�ʵ�����ݼ��±���
��� | �¶� | ʱ��/min n/mol | 0 | 10 | 20 | 40 | 50 |
�� | T1 | n(CH4) | 0.50 | 0.35 | 0.25 | 0.10 | 0.10 |
�� | T2 | n(CH4) | 0.50 | 0.30 | 0.18 | 0.15 |
����˵����ȷ������ ��
A. ��ʵ�����ݿ�֪ʵ����Ƶ��¶�T2>T1
B. ������У�0~20min�ڣ�NO2�Ľ�������Ϊ0.0125mol��L-1��min-1
C. 40minʱ��������T2��Ӧ������Ϊ0.18
D. 0��10min�ڣ�CH4�Ľ���������>��
���𰸡�A
��������A. ��ʵ�����ݿ�֪����ǰ10min�ڣ���T2�¶��£�����ı仯���ϴ������ڸ��¶��»�ѧ��Ӧ���ʽϿ죬��ˣ�ʵ����Ƶ��¶�T2>T1��A��ȷ��B. �����У�0~20min�ڣ�����ı仯��Ϊ0.25mol����NO2�ı仯��Ϊ0.50mol�������併������Ϊ![]() 0.025mol��L-1��min-1��B����ȷ��C. �ɱ������ݿ�֪��40minʱ��ʵ��ٵķ�Ӧ�Ѵ�ƽ��״̬�������¶Ƚϸߡ���Ӧ���ʽϿ��ʵ����У���Ӧһ���ﵽƽ��״̬�����Ա�����T2��Ӧ������Ϊ0.15��C����ȷ��D.��A�ķ�����֪�� 0��10min�ڣ�CH4�Ľ������ʢ�<�ڣ�D����ȷ������ѡA��
0.025mol��L-1��min-1��B����ȷ��C. �ɱ������ݿ�֪��40minʱ��ʵ��ٵķ�Ӧ�Ѵ�ƽ��״̬�������¶Ƚϸߡ���Ӧ���ʽϿ��ʵ����У���Ӧһ���ﵽƽ��״̬�����Ա�����T2��Ӧ������Ϊ0.15��C����ȷ��D.��A�ķ�����֪�� 0��10min�ڣ�CH4�Ľ������ʢ�<�ڣ�D����ȷ������ѡA��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������ɢϵ�������Ȼ�̼���Ȼ�����Һ�ڵ�Ƣ۵�ˮ���������ϸ����Һ����Ҫ����������
A.��Һ����ȡ����ȡB.��ȡ������Һ
C.��Һ��������ȡD.��Һ����ȡ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ����
A.��������Һ�ı������������Ƿ���ж����ЧӦ
B.����ʵ�����Ҫͨ�����ʵ��
C.ֻ����һ��Ԫ�ص�����һ���Ǵ�����
D.��Fe(OH)3��������εμ�ϡ���ᣬ�ȳ��ֳ��������������ܽ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��
��1������ȼ�տ���ͨ����������;����
;��I��C3H8��g�� + 5O2��g�� = 3CO2��g�� +4H2O��l�� ��H��-a kJ��mol-1
;��II��C3H8��g�� = C3H6��g��+ H2��g�� ��H��+b kJ��mol-1
2C3H6��g��+ 9O2��g�� = 6CO2��g�� +6H2O��l�� ��H��-c kJ��mol-1
2H2��g��+O2 ��g�� = 2H2O��l�� ��H��-d kJ��mol-1 ��abcd��Ϊ��ֵ��
��ش��������⣺
���жϵ����ı���ͨ������;���ų���������;��I�ų�������������ڡ��������ڡ���С�ڡ���;��II�ų���������
��b ��a��c��d����ѧ��ϵʽ�� ��
��2���״���һ����Ҫ���Լ������Ź㷺����;����ҵ�Ͽ�����CO2�Ʊ��״�����CH4��CO2��Ӧ��H2��CO��������H2��CO�����Ƽ״�����֪:
�� 2CH3OH��l��+3O2��g��=2CO2��g��+4H2O��l�� ��H1=-1450.0kJ��mol��1
�� 2CO��g��+O2��g��=2CO2��g�� ��H2=-566.0kJ��mol��1
�� 2H2��g��+O2��g��=2H2O��l�� ��H3=-571.6kJ��mol��1
��H2��CO��Һ̬�״����Ȼ�ѧ����ʽΪ��
��3����ͼ��ʾ��ijͬѧ���һ�����ѣ�CH3OCH3��ȼ�ϵ�ز�̽���ȼҵԭ���ʹ�ͭ�ľ���ԭ����������װ����XΪ�����ӽ���Ĥ��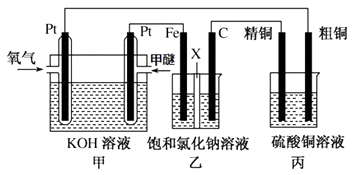
����Ҫ��ش�������⣺
��д������ͨ����һ���ĵ缫��Ӧʽ��
�����з������ܷ�Ӧ�����ӷ���ʽΪ��
�۽�0.2mol AgNO3��0.4mol Cu��NO3��2 ��0.6mol KCl����ˮ�����100ml��Һ���ö��Ե缫���һ��ʱ���ijһ�缫��������0.3mol Cu����ʱ����һ�缫�ϲ����������������״����Ϊ L����Ҫʹ�������Һ�ָ������ǰ��״̬����Ҫ������������Ϊg ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���±���25 ��ʱijЩ����ĵ���ƽ�ⳣ����
��ѧʽ | CH3COOH | HClO | H2CO3 | H2C2O4 |
Ka | Ka��1.8��10��5 | Ka��3.0��10��8 | Ka1��4.1��10��7 | Ka1��5.9��10��2 |
��1��H2C2O4�뺬�����ʵ�����KOH����Һ��Ӧ��������Һ�����ԣ�����Һ�и�����Ũ���ɴ�С��˳��Ϊ��
��2����0.1 mol��L��1 CH3COOH��Һ�еμ�NaOH��Һ��c��CH3COOH����c��CH3COO������5��9����ʱ��ҺpH����
��3����̼������Һ�еμ�������ˮ�����ӷ���ʽΪ��
��4����0.1mol��L��1CH3COOH��Һ��0.1mol��L��1NaOH��Һ�������ϣ����Ի�Ϻ���Һ����ı仯������û����Һ��pH��8����c��Na+��-c��CH3COO����=mol��L��1���ȷ����������
��5����CH3COOH��Һ�����ʯ��Ӧ�������ı����44.8L����ȫ��ͨ�뵽2L 1.5mol/L��NaOH��Һ�г�ַ�Ӧ������Һ���������ӵ����ʵ���Ũ���ɴ�С��˳��Ϊ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����л���A��F�ϳ�I��J�߾���H���������£�

��֪����
��
���л���B�ķ���ʽΪC4H6Br2����˴Ź���������2��壬�ҷ����֮��Ϊ1��2��
��ش���������
��1���л���F��������________����Ӧ�������Լ�a����������? ________________������ԡ���ԭ�ԡ�)��
��2���߾���H�Ľṹ��ʽΪ_____________����֪J�к���һ����Ԫ������J�Ľṹ��ʽΪ________________��
��3��D��E�Ļ�ѧ����ʽΪ________________����Ӧ����Ϊ________________��
��4��1mol��E����I����������________molH2��B��C����Է��������IJ�ֵΪ________��
��5��C��ͬ���칹��������������������________�֡�
�ٿ��Է���������Ӧ �ڿ���������Ʒ�Ӧ��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Һ��ֻ���ܺ���H+��NH4+��Mg2+��Al3+��Fe3+��CO32-��SO42-��NO3-�еļ��֡���������п��,������ɫ��ζ�����壻��������NaOH��Һ,������ɫ����,�Ҳ����ij����������NaOH����ؠ����֮��Ĺ�ϵ��ͼ��ʾ���������h����ȷ����( )

A. ��Һ�е�������һ������H+��Mg2+��Al3+�����ܺ���Fe3+
B. ��Һ��һ������CO32-��NO3-��һ������SO42-
C. ��Һ��C(NH4+)=0.2mol/L
D. c(H+):c(Al3+):c(Mg2+)=l:1:1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���л�������K��һ�־������ϣ��ϳ�·��������

��֪����AlCl3Ϊ����A���л���Ӧ�Ĵ���
��F������������Һ������Ӧ��������Na��Ӧ��
��1������A��������Ӧ����Ϊ________������A��������Ӧ��Ϊ����������
��һ����CH3COCl+AlCl3��CH3CO++AlCl4��
�ڶ�����____________________
��������AlCl4-+H+��AlCl3+HCl
��д���ڶ�����Ӧ��
��2��B�Ļ�ѧ����Ϊ��Ӧ������Ϊ______________����Ӧ������Ϊ_______________��
��3������Ȳ����F�Ļ�ѧ����ʽΪ____________________��
��4��F��ͬ���칹��ܶ࣬������ͬʱ����������4����������״�����ﹲ��_________��(����˳���칹�Ͷ�ӳ�칹)��
���������ֹ����������������Ƶ�Cu(OH)2����Һ��Ӧ������ԭ�Ӳ���̼̼˫������
����Na��Ӧ�ɷų�����
��5��K�Ľṹ��ʽΪ_________________��
��6��������Ȳ�ͱ�ͪΪԭ�ϣ����ռӳɡ��ӳɡ���ȥ�ķ�Ӧ����˳�������ϳ���Ȼ�ĵ��塣(���Լ���ѡ)________________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й������Ը��������Һ��ɫ��˵����ȷ���ǣ� ��
A. ����ͬϵ�ﶼ��ʹ���Ը��������Һ��ɫ
B. 2-��-3-��ϩ��ʹ���Ը��������Һ��ɫ
C. �������Ը��������Һ��ȥ�����е���ϩ
D. ����Ȳ����ʹ���Ը��������Һ����ˮ��ɫ
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com