
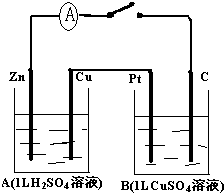
分析 (1)该装置中A能自发的进行氧化还原反应,构成原电池,则B是电解池,A中锌易失电子作负极、Cu作正极,连接负极的电极是阴极、连接正极的电极是阳极;
(2)如果要用B池给铁片上镀上一层Cu,则阳极为铜,阴极为铁片.
解答 解:(1)该装置中A能自发的进行氧化还原反应,构成原电池,则B是电解池,A中锌易失电子作负极、Cu作正极,连接负极的电极C是阴极、连接正极的电极Pt是阳极,故答案为:原电池;负极;电解池;阳极;
(2)如果要用B池给铁片上镀上一层Cu,则阳极为铜,阴极为铁片,所以将B池的Pt电极换作Cu;C电极换作铁片;
故答案为:Cu,铁片.
点评 本题考查了原电池和电解池原理,明确电镀原理及各个电极上发生的反应是解本题关键,题目难度不大.


 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案科目:高中化学 来源: 题型:解答题
| 熔点/K | 沸点/K | 水中的溶解度(标准状况) | |
| H2S | 187 | 202 | 2.6 |
| H2O2 | 272 | 423 | 以任意比互溶 |
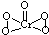 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 增大 | B. | 减小 | ||
| C. | 不变 | D. | 可能增大也可能减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
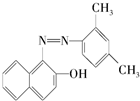 已知氮氮双键不能与Br2发生加成反应.苏丹红是很多国家禁止用于食品生产的合成色素,结构简式如图.下列关于苏丹红的说法中错误的是( )
已知氮氮双键不能与Br2发生加成反应.苏丹红是很多国家禁止用于食品生产的合成色素,结构简式如图.下列关于苏丹红的说法中错误的是( )| A. | 苏丹红属于芳香烃 | |
| B. | 苏丹红能与FeCl3溶液发生显色反应 | |
| C. | 苏丹红能被酸性KMnO4溶液氧化 | |
| D. | 1 mol苏丹红最多可与1 mol Br2发生取代反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加热时无气体放出 | |
| B. | 溶于水后滴加稀BaCl2溶液有白色沉淀生成 | |
| C. | 滴加盐酸时有气泡放出 | |
| D. | 溶于水后滴加澄清石灰水有白色沉淀生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②④⑤ | B. | ①② | C. | ②④ | D. | ①⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
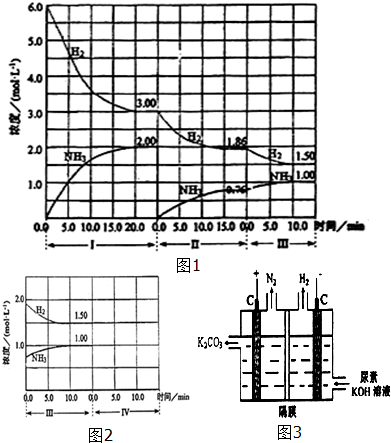
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com