
| ℃ | NO2 | HF |
| 熔点 | -11.2 | -83.6 |
| 沸点 | 21.0 | 19.52 |
| A、20.0 gHF中含σ键数目为1.0NA |
| B、将22.4LNH3溶于1L水中,溶液含有OH-数目为0.1NA |
| C、6.72 LNO2与水反应后,转移的电子数为0.2NA |
| D、H2S和SO2各0.l mol反应后,体系中的S原子数目小于0.2NA |
| m |
| M |
| m |
| M |
| 20g |
| 20g/mol |


科目:高中化学 来源: 题型:
 )及其衍生物冬青油(结构简式:
)及其衍生物冬青油(结构简式: )和阿司匹林(结构简式:
)和阿司匹林(结构简式: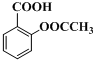 )都是常用的药物.完成下列填空:
)都是常用的药物.完成下列填空: ),写出该合成过程的化学方程式.
),写出该合成过程的化学方程式.查看答案和解析>>
科目:高中化学 来源: 题型:
 116号元素已被命名为“鉝”;2014年5月,科学家已确认发现117号元素,未命名,元素符号Uus;若将元素周期表的“一列”看作“一族”;则对117号元素的相关表述或性质推断错误的是( )
116号元素已被命名为“鉝”;2014年5月,科学家已确认发现117号元素,未命名,元素符号Uus;若将元素周期表的“一列”看作“一族”;则对117号元素的相关表述或性质推断错误的是( )| A、属第17族元素 |
| B、属卤族元素 |
| C、属非金属元素 |
| D、有放射性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、醋酸水溶液能使湿润的蓝色石蕊试纸变红 |
| B、醋酸和碳酸钠溶液反应放出二氧化碳 |
| C、c(H+)相同的醋酸和盐酸相比较,醋酸溶液的浓度大 |
| D、浓度和体积均相同的醋酸和盐酸可中和等物质的量的NaOH |
查看答案和解析>>
科目:高中化学 来源: 题型:
 如图所示,用甲醇和氧气以及强碱做电解质溶液的新型燃料电池做电源,对A、B 装置通电一段时间后,发现有1.6g甲醇参加反应且③电极增重(假设工作时无能量损失).请回答下列问题:
如图所示,用甲醇和氧气以及强碱做电解质溶液的新型燃料电池做电源,对A、B 装置通电一段时间后,发现有1.6g甲醇参加反应且③电极增重(假设工作时无能量损失).请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、CH4?14H2O | ||
| B、CH4?8H2O | ||
C、CH4?
| ||
| D、CH4?6H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:

| 第一次 | 第二次 | 第三次 | 第四次 | |
| 体积(mL) | 24.00 | 24.10 | 22.40 | 23.90 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com