
【题目】向40mL某浓度的AlCl3溶液中滴加2mol/L的NaOH溶液时,所得的沉淀质量与加入NaOH溶液的体积之间的关系如下图所示:
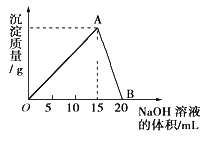
(1)写出AB段发生反应的离子方程式___________。
(2)A点表示的意义是__________。
(3)当所得沉淀量为0.39g时,用去NaOH溶液的体积是_______ mL。
(4)向B点处的溶液中通入少量CO2会有什么现象________写出离子方程式________。
【答案】Al(OH)3+OH-=AlO2-+2H2O AlCl3和NaOH溶液恰好完全反应,沉淀量达到最大值 7.5 或 17.5 出现沉淀 2AlO2-+CO2(少量)+3H2O=CO32-+2Al(OH)3↓
【解析】
开始AlCl3与NaOH反应Al3++3OH-=Al(OH)3↓,生成Al(OH)3沉淀,NaOH量逐渐增多,Al(OH)3量逐渐增大,到A点时氢氧化钠将AlCl3恰好完全沉淀,Al(OH)3沉淀达到最大量;随后再加NaOH,发生Al(OH)3+OH-=AlO2-+2H2O,沉淀量又逐渐减少,到B点时Al(OH)3与NaOH恰好完全反应生成NaAlO2,沉淀完全溶解消失;0.39 g Al(OH)3的物质的量=![]() 0.005mol.当NaOH溶液不足时,生成0.39 g Al(OH)3所需NaOH的物质的量为0.015 mol;当NaOH溶液过量时,还剩余0.39 g Al(OH)3,剩余0.39 g Al(OH)3溶解可以消耗0.005molNaOH,故共消耗NaOH的物质的量=0.02L×2mol/L-0.005mol=0.035 mol,根据V=
0.005mol.当NaOH溶液不足时,生成0.39 g Al(OH)3所需NaOH的物质的量为0.015 mol;当NaOH溶液过量时,还剩余0.39 g Al(OH)3,剩余0.39 g Al(OH)3溶解可以消耗0.005molNaOH,故共消耗NaOH的物质的量=0.02L×2mol/L-0.005mol=0.035 mol,根据V=![]() 计算NaOH溶液的体积;B点处的溶液是偏铝酸钠溶液,通入少量CO2生成碳酸钠和氢氧化铝沉淀。
计算NaOH溶液的体积;B点处的溶液是偏铝酸钠溶液,通入少量CO2生成碳酸钠和氢氧化铝沉淀。
根据以上分析,(1)AB段发生的反应是Al(OH)3与NaOH反应生成偏铝酸钠,反应离子方程式是Al(OH)3+OH-=AlO2-+2H2O;(2)开始AlCl3与NaOH反应Al3++3OH-=Al(OH)3↓,生成Al(OH)3沉淀,NaOH量逐渐增多,Al(OH)3量逐渐增大,到A点时氢氧化钠将AlCl3恰好完全沉淀,Al(OH)3沉淀达到最大量;(3)0.39 g Al(OH)3的物质的量=![]() 0.005mol;当NaOH溶液不足时,生成0.39 g Al(OH)3所需NaOH的物质的量为0.005mol×3=0.015 mol,需要NaOH溶液的体积=
0.005mol;当NaOH溶液不足时,生成0.39 g Al(OH)3所需NaOH的物质的量为0.005mol×3=0.015 mol,需要NaOH溶液的体积=![]() 0.0075L=7.5mL;当NaOH溶液过量时,还剩余0.39 g Al(OH)3,剩余0.39 g Al(OH)3溶解可以消耗0.005molNaOH,故共消耗NaOH的物质的量=0.02L×2mol/L-0.005mol=0.035 mol,需要NaOH溶液的体积=
0.0075L=7.5mL;当NaOH溶液过量时,还剩余0.39 g Al(OH)3,剩余0.39 g Al(OH)3溶解可以消耗0.005molNaOH,故共消耗NaOH的物质的量=0.02L×2mol/L-0.005mol=0.035 mol,需要NaOH溶液的体积=![]() 0.0175L=17.5mL;(4)B点处的溶液是偏铝酸钠溶液,通入少量CO2生成碳酸钠和氢氧化铝沉淀,现象是出现白色沉淀,反应离子方程式是2AlO2-+CO2(少量)+3H2O=CO32-+2Al(OH)3↓。
0.0175L=17.5mL;(4)B点处的溶液是偏铝酸钠溶液,通入少量CO2生成碳酸钠和氢氧化铝沉淀,现象是出现白色沉淀,反应离子方程式是2AlO2-+CO2(少量)+3H2O=CO32-+2Al(OH)3↓。


 寒假学与练系列答案
寒假学与练系列答案科目:高中化学 来源: 题型:
【题目】通过简单的计算完成下列问题:
(1)已知:常温下HF的Ka=1×10-4,NH3H2O的Kb=1×10-5,则NH4F溶液显_______性,保存此溶液应该放在_______中。
(2)已知:常温下 H2S的Ka1=1×10-7、Ka2=1×10-15,CuS的Ksp=1×10-36,FeS的Ksp=1×10-17,则:
①反应CuS(s)+2HCl(aq)![]() H2S(aq)+CuCl2(aq)的K=__________;反应FeS(s)+2HCl(aq)
H2S(aq)+CuCl2(aq)的K=__________;反应FeS(s)+2HCl(aq)![]() H2S(aq)+FeCl2(aq)的 K=_____;
H2S(aq)+FeCl2(aq)的 K=_____;
由计算结果我们可以知道CuS和FeS中________可溶于盐酸。
②反应 CuS(s)+Fe2+(aq)![]() FeS(s)+Cu2+(aq)的K=_____;除去废水中的 Cu2+使用过量的FeS固体的优点有:a.可以除去废水中的Cu2+,过量的FeS和生成的CuS可以通过过滤一并除去;b. _________________________________。
FeS(s)+Cu2+(aq)的K=_____;除去废水中的 Cu2+使用过量的FeS固体的优点有:a.可以除去废水中的Cu2+,过量的FeS和生成的CuS可以通过过滤一并除去;b. _________________________________。
(3)已知:常温下 Fe(OH)3的 Ksp=1×10-38,则 Fe3+沉淀完全的pH=______;配置FeCl3溶液的方法是______。(以浓度≤10-5mol/L为沉淀完全)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用铁、铝的混合物进行如下实验:

(1)操作X的名称是___________。
(2)气体A是___________。
(3)加入足量NaOH 溶液时发生反应的离子方程式为______________;加入盐酸发生反应的离子方程式为_______________。
(4)溶液B 中阴离子除OH-外还有_________,溶液D中存在的金属离子为___________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,A处通入Cl2,关闭B阀时,C处湿润的红色布条无变化;

打开B阀时,C处湿润的红色布条褪色,则D中的溶液是 ( )
A. 浓H2SO4 B. H2O
C. NaOH溶液 D. 饱和食盐水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用下述装置制取氯气,并用氯气进行下列实验。看图回答下列问题:

(1)A、B两仪器的名称:A________,B________。
(2)写出实验室制氯气的化学方程式,并用单线桥法表示上述反应电子转移的方向和数目_____________。
(3)洗气装置C是为了除去Cl2中的HCl气体,D是为了干燥Cl2,则C、D中应分别放入的试剂是C______________,D______________。
(4)P为尾气吸收装置,写出实验室吸收氯气的反应的离子方程式_______________。
(5)ClO2具有很强的氧化性,因此常被用作消毒剂,其消毒的效率(以单位质量得到的电子数表示)是Cl2的________倍。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知NaHCO3的溶解度较小。在饱和的NH3和NaCl的混合溶液中通入CO2,可析出NaHCO3(固体):NaCl+NH3+CO2+H2O=NaHCO3↓+NH4Cl。据此,我国杰出的化学家侯德榜设计出了生产纯碱的方法:
饱和NaCl(溶液)![]() NaHCO3
NaHCO3![]() Na2CO3
Na2CO3
这种方法被人们称为侯氏制碱法,打破了帝国主义对我国经济的一种封锁,大长了中国人的民族志气。
试回答下列问题:
(1)写出由NaHCO3固体制取Na2CO3的化学方程式:__________________。
(2)如果Na2CO3(固体)中混有NaHCO3(固体),应如何除去?_____________(写出方法);如果NaHCO3(溶液)中混有Na2CO3(溶液),应如何除去?________(写出化学方程式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种新型太阳光电化学电池贮能时电解质溶液中离子在两极发生如下图所示的转化。

下列说法正确的是( )
A. 贮能时,电能转变为化学能和光能
B. 贮能和放电时,电子在导线中流向相同
C. 贮能时,氢离子由a极区迁移至b极区
D. 放电时,b极发生:VO2++2H++e-=VO2++H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】学习化学可以防止走入生活和学习的误区.你认为下列说法不正确的是( )
A.水银不是银,而是金属汞
B.纯碱不是碱,而是盐
C.干冰不是冰,而是固体二氧化碳
D.烧碱不是碱,而是一种常见的盐
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com