
【题目】核黄素又称为维生素B2,可促进发育和细胞再生,有利于增进视力,减轻眼睛疲劳.核黄素分子的结构为 ,已知:
,已知:![]() ,有关核黄素的下列说法中,不正确的是
,有关核黄素的下列说法中,不正确的是
A. 该化合物的分子式为C17H22N4O6
B. 酸性条件下加热水解,有CO2生成
C. 酸性条件下加热水解,所得溶液加碱后有NH3生成
D. 能发生酯化反应
 小天才课时作业系列答案
小天才课时作业系列答案 一课四练系列答案
一课四练系列答案 黄冈小状元满分冲刺微测验系列答案
黄冈小状元满分冲刺微测验系列答案 新辅教导学系列答案
新辅教导学系列答案 阳光同学一线名师全优好卷系列答案
阳光同学一线名师全优好卷系列答案科目:高中化学 来源: 题型:
【题目】下列具有特殊性能的材料中,由主族元素和副族元素形成的化合物是( )
A. 半导体材料砷化镓 B. 吸氢材料镧镍合金
C. 透明陶瓷材料硒化锌 D. 超导材料K3C60
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,将1.92g铜加入到100ml H2SO4和HNO3的混合液中,Cu全部溶解,放出无色气体,再向溶液中加入足量铁粉,充分反应,此时收集到气体为448ml(标准状况)的氢气.下列有关结论不正确的是( )
A.溶解的铁粉为2.8g
B.原溶液中c(SO42﹣)=0.5mol/L
C.原混合溶液中c(H+)=1.2mol/L
D.原溶液中n(NO3﹣)=0.08mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物含碳85.7%,含氢14.3%,向80g含溴5%的溴水中通入该有机物,溴水恰好完全褪色,此时液体总质量为81.4g.求:
(1)有机物的分子式.
(2)经测定,该有机物分子中有两个﹣CH3 , 试写出它的结构简式.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将下列物质分别注入水中,振荡后静置,能分层且浮于水面的是( )
①溴苯 ②乙酸乙酯 ③乙醇 ④甘油 ⑤油酸甘油酯 ⑥硝基苯
A.全部
B.①②⑤⑥
C.②⑤
D.①⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】污染物的有效去除和资源的充分利用是化学造福人类的重要研究课题.某研究小组利用软锰矿(主要成分为MnO2 , 另含有少量铁、铝、铜、镍等金属化合物)作脱硫剂,通过如下简化流程既脱除燃煤尾气中的SO2 , 又制得电池材料MnO2(反应条件已省略).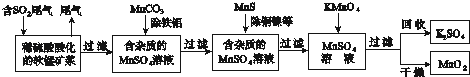
请回答下列问题:
(1)上述流程脱硫实现了(选填下列字母编号).
A.废弃物的综合利用
B.白色污染的减少
C.酸雨的减少
(2)用MnCO3能除去溶液中的Al3+和Fe3+ , 其原因是 .
(3)已知:25℃、101kPa时,Mn(s)+O2(g)═MnO2(s)△H=﹣520kJ/mol
S(s)+O2(g)═SO2(g)△H=﹣297kJ/mol
Mn(s)+S(s)+2O2(g)═MnSO4(s)△H=﹣1065kJ/mol
SO2与MnO2反应生成无水MnSO4的热化方程式是 .
(4)MnO2可作超级电容器材料.用惰性电极电解MnSO4溶液可制得MnO2 , 其阳极的电极反应式是 .
(5)MnO2是碱性锌锰电池的正极材料.碱性锌锰电池放电时,正极的电极反应式是 .
(6)假设脱除的SO2只与软锰矿浆中的MnO2反应.按照图示流程,将a m3(标准状况)含SO2的体积分数为b%的尾气通入矿浆,若SO2的脱除率为89.6%,最终得到MnO2的质量为ckg,则除去铁、铝、铜、镍等杂质时,所引入的锰元素相当于MnO2kg.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国药学家屠呦呦因发现植物黄花蒿叶中含有抗疟疾的物质﹣青蒿素而荣获2015年诺贝尔奖.科学家对青蒿素的结构进行进一步改良,合成药效更佳的双氢青蒿素、蒿甲醚.下列说法不正确的是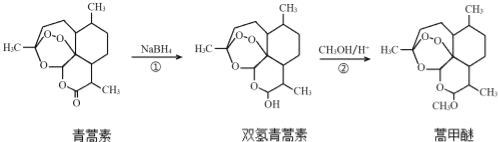
A. 利用黄花蒿叶研究青蒿素结构的基本步骤为:分离、提纯→元素分析确定实验式→测定相对分子质量确定分子式→波谱分析确定结构式
B. 双氢青蒿素在水中的溶解性大于青蒿素
C. ①、②的反应类型分别为还原反应、取代反应
D. 青蒿素转化为双氢青蒿素,手性碳个数不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W、Q、R均为前四周期元素,且原子序数依次增大.其相关信息如下表所示:
X元素的基态原子中电子分布在三个不同的能级中,且每个能级中的电子总数相同 |
Y元素的气态氢化物与其最高价氧化物对应的水化物能发生化合反应 |
Z元素的族序数是其周期数的三倍 |
W原子的第一至第六电离能分别为:I1=578KJmol﹣1 I2=1817KJmol﹣1 I3=2745KJmol﹣1I4=11575KJmol﹣1 I5=14830KJmol﹣1 I6=18376KJmol﹣1 |
Q为前四周期中电负性最小的元素 |
元素R位于周期表的第10列 |
回答下列问题:
(1)Y元素的基态原子中未成对电子数为;X、Y、Z三种元素原子的第一电离能由小到大的顺序为(用元素符号表示).
(2)W的氯化物的熔点比Q的氯化物的熔点(填“高”或“低”),理由是
(3)光谱证实元素W的单质与强碱性溶液反应有[W(OH)4]﹣生成,则[W(OH)4]﹣中存在(填字母) . a.极性共价键 b.非极性共价键 c.配位键 d.氢键
(4)含有X、R和镁三种元素的某种晶体具有超导性,其结构如图所示.则该晶体的化学式为;晶体中每个镁原子周围距离最近的R原子有个.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com