
| A. | N、P、As的电负性随原子序数的增大而增大 | |
| B. | 价电子排布为4s24p3的元素位于第四周期第ⅤA族,是p区元素 | |
| C. | 2p和3p轨道形状均为哑铃形,能量也相等 | |
| D. | 镁原子由1s22s22p63s2→1s22s22p63p2时,原子释放能量,由基态转化成激发态 |
分析 A.同主族元素,从上到下电负性减弱;
B.价电子排布为4s24p3的元素有4个电子层、最外层电子数为5,最后填充p电子;
C.离原子核越远,能量越高;
D.基态Mg的电子排布式为1s22s22p63s2,由基态转化成激发态,电子能量增大,需要吸收能量.
解答 解:A.同主族元素从上到下,电负性减小,则N、P、As的电负性随原子序数的增大而减小,故A错误;
B.价电子排布为4s24p3的元素有4个电子层、最外层电子数为5,位于第四周期第ⅤA族,最后填充p电子,是p区元素,故B正确;
C.p轨道均为纺锤形,离原子核越远,能量越高,2p轨道能量低于3p,故C错误;
D.基态Mg的电子排布式为1s22s22p63s2,由基态转化成激发态,电子能量增大,需要吸收能量,故D错误,
故选B.
点评 本题考查原子核外电子的排布、电负性,把握电子排布规律及电子排布与元素位置的关系即可解答,注意规律性知识的总结和应用,题目难度不大.


科目:高中化学 来源: 题型:多选题
| A. | 活化分子具有的能量比普通分子的能量高 | |
| B. | 发生有效碰撞的分子必为活化分子 | |
| C. | 活化分子之间的碰撞一定都是有效碰撞 | |
| D. | 活化分子数目越多,反应速率一定会变快 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
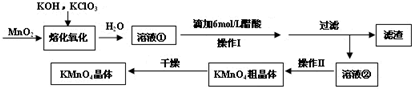
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
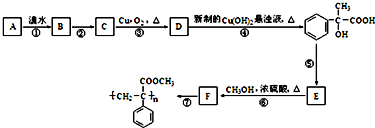
 .
.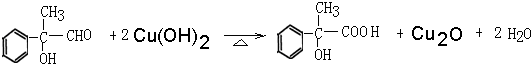 .
.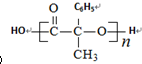 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 已达平衡状态 | B. | 未达平衡状态,反应正向进行 | ||
| C. | 未达平衡状态,反应逆向进行 | D. | 无法确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入少量的KCl固体 | B. | 加入少量FeCl3固体 | ||
| C. | 降低Fe(SCN)3的浓度 | D. | 加水稀释 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
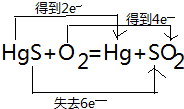 ,氧化剂是HgS、O2,还原产物:Hg、SO2.
,氧化剂是HgS、O2,还原产物:Hg、SO2.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
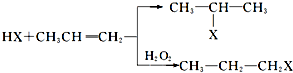 工业上按下列路线合成结构见识为:
工业上按下列路线合成结构见识为: 的物质,该物质的一种香料.
的物质,该物质的一种香料.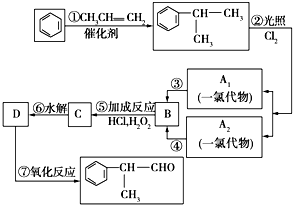
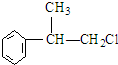 ;A2
;A2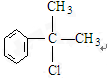 .
.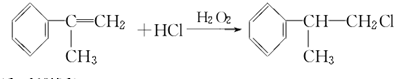 .
.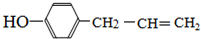 、,
、,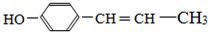 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com