
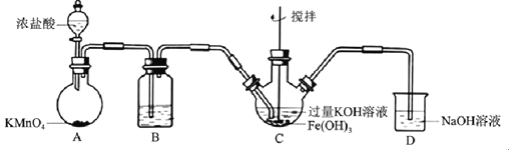
【题目】高铁酸盐是优良的多功能水处理剂。某实验小组釆用如图装置制备高铁酸钾![]() 并探究其性质用途。
并探究其性质用途。
资料:![]() 为紫色固体,微溶于KOH溶液,难溶于有机溶剂;具有强氧化性在酸性或中性溶液中紫色快速褪去并产生
为紫色固体,微溶于KOH溶液,难溶于有机溶剂;具有强氧化性在酸性或中性溶液中紫色快速褪去并产生![]() ,在碱性溶液中较稳定。
,在碱性溶液中较稳定。
Ⅰ![]() 制备
制备![]() 夹持、加热等装置略
夹持、加热等装置略![]()
![]() 中所用试剂为______。
中所用试剂为______。
![]() 中反应为放热反应,而反应温度须控制在
中反应为放热反应,而反应温度须控制在![]() ,可使用的控温方法为______,充分反应后得到紫色固体,反应方程式为______。反应中KOH必须过量的原因是______。
,可使用的控温方法为______,充分反应后得到紫色固体,反应方程式为______。反应中KOH必须过量的原因是______。
![]() 中混合物经过滤、洗涤、干燥,得纯浄髙铁酸钾晶体,洗涤时洗涤剂可选用______。
中混合物经过滤、洗涤、干燥,得纯浄髙铁酸钾晶体,洗涤时洗涤剂可选用______。
![]() 冰水
冰水![]() 溶液
溶液![]() 异丙醇
异丙醇
Ⅱ![]() 探究
探究![]() 的性质
的性质
![]() 可以将废水中的
可以将废水中的![]() 氧化为
氧化为![]() ,实验表明,
,实验表明,![]() 时
时![]() 去除效果最佳。配平反应离子方程式:
去除效果最佳。配平反应离子方程式:
______![]() ______
______![]() ______
______![]() ______
______![]() ______
______![]() ______
______![]() 。现处理含
。现处理含![]() 离子浓度为
离子浓度为![]() 的废水
的废水![]() ,至少需要
,至少需要![]() ______g。
______g。
![]() 资料表明,酸性溶液中氧化性
资料表明,酸性溶液中氧化性![]() 验证实验:将少量
验证实验:将少量![]() 溶解在过量KOH溶液中,溶液呈浅紫色,取该溶液滴入
溶解在过量KOH溶液中,溶液呈浅紫色,取该溶液滴入![]() 和
和![]() 的混合溶液中,振荡,溶液颜色仍然呈浅紫色。请设计实验证明最后所得浅紫色溶液中含有
的混合溶液中,振荡,溶液颜色仍然呈浅紫色。请设计实验证明最后所得浅紫色溶液中含有![]() ______。
______。
【答案】饱和食盐水 冷水浴 ![]() 保持溶液碱性,防止
保持溶液碱性,防止![]() 变质
变质 ![]()
![]() 3 5 2 3 4 66 向最后的浅紫色溶液中滴加过量稀硫酸,振荡,溶液浅紫色未褪去
3 5 2 3 4 66 向最后的浅紫色溶液中滴加过量稀硫酸,振荡,溶液浅紫色未褪去
【解析】
由实验装置可知,A中发生反应生成氯气,B中饱和食盐水可除去氯气中的氯化氢,C中在碱性条件下氯气可以氧化氢氧化铁制取高铁酸钾,洗涤时选异丙醇可减少晶体溶解损失,且醇容易挥发,易于干燥。
(4)铁元素的化合价从+6降低为+3价,碳元素的化合价从+2价升高为+4价,结合电子和电荷守恒配平;结合电子守恒计算需要的高铁酸钾。
(5)设计实验证明最后所得浅紫色溶液中的高锰酸根离子,可以利用酸性溶液中高铁酸根离子不稳定,加过量硫酸判断。
Ⅰ(1)由上述分析可知,B中所用试剂为饱和食盐水,故答案为:饱和食盐水;
(2)C中反应为放热反应,而反应温度须控制在![]() ,可使用的控温方法为冷水浴,充分反应后得到紫色固体,
,可使用的控温方法为冷水浴,充分反应后得到紫色固体,
反应方程式为![]() 反应中KOH必须过量的原因是保持溶液碱性,防止
反应中KOH必须过量的原因是保持溶液碱性,防止![]() 变质,
变质,
故答案为:冷水浴;![]() ;保持溶液碱性,防止
;保持溶液碱性,防止![]() 变质;
变质;
(3)C中混合物经过滤、洗涤、干燥,得纯浄高铁酸钾晶体,洗涤时洗涤剂可选用异丙醇,选水时晶体溶解,选KOH时引入新杂质,
故答案为:c;
Ⅱ![]()
![]() 元素的化合价由
元素的化合价由![]() 价降低为
价降低为![]() 价,C元素的化合价由
价,C元素的化合价由![]() 价升高为
价升高为![]() 价,由电子、电荷及原子守恒可知离子反应为
价,由电子、电荷及原子守恒可知离子反应为![]() ;由电子守恒可知处理含
;由电子守恒可知处理含![]() 离子浓度为
离子浓度为![]() 的废水
的废水![]() ,至少需要
,至少需要![]() 为
为![]() ,
,
故答案为:2;3;5;2;3;4;66;
![]() 证明最后所得浅紫色溶液中含有
证明最后所得浅紫色溶液中含有![]() ,设计实验为向最后的浅紫色溶液中滴加过量稀硫酸,振荡,溶液浅紫色未褪去,
,设计实验为向最后的浅紫色溶液中滴加过量稀硫酸,振荡,溶液浅紫色未褪去,
故答案为:向最后的浅紫色溶液中滴加过量稀硫酸,振荡,溶液浅紫色未褪去。


 黄冈冠军课课练系列答案
黄冈冠军课课练系列答案 长江作业本同步练习册系列答案
长江作业本同步练习册系列答案科目:高中化学 来源: 题型:
【题目】根据vt图分析外界条件改变对可逆反应A(g)+3B(g) ![]() 2C(g) ΔH<0的影响。该反应的速率与时间的关系如图所示:
2C(g) ΔH<0的影响。该反应的速率与时间的关系如图所示:
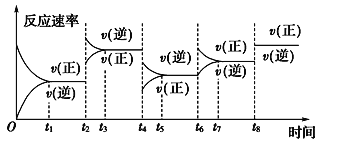
可见在t1、t3、t5、t7时反应都达到平衡,如果t2、t4、t6、t8时都只改变了一个反应条件,则下列对t2、t4、t6、t8时改变条件的判断正确的是
A. 使用了催化剂、增大压强、减小反应物浓度、降低温度
B. 升高温度、减小压强、减小反应物浓度、使用了催化剂
C. 增大反应物浓度、使用了催化剂、减小压强、升高温度
D. 升高温度、减小压强、增大反应物浓度、使用了催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Fenton法常用于处理含难降解有机物的工业废水,通常是在调节好pH和Fe2+浓度的废水中加入H2O2,所产生的羟基自由基能氧化降解污染物。现运用该方法降解有机污染物pCP,探究有关因素对该降解反应速率的影响。
[实验设计]控制pCP的初始浓度相同,恒定实验温度在298 K或313 K(其余实验条件见下表),设计如下对比实验。
(1)请完成以下实验设计表(表中不要留空格)。
编号 | 实验目的 | T/K | pH | c/10-3 mol/L | |
H2O2 | Fe2+ | ||||
① | 为以下实验作参考 | 298 | 3 | 6.0 | 0.30 |
② | 探究温度对降解反应速率的影响 | ____ | ____ | ____ | ____ |
③ | ____ | 298 | 10 | 6.0 | 0.30 |
[数据处理]实验测得pCP的浓度随时间变化的关系如图:
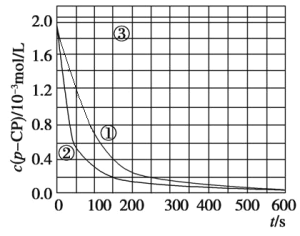
(2)请根据图中实验①曲线,列式并计算降解反应在50~150 s内的反应速率:________。
[解释与结论]
(3)实验①②表明温度升高,降解反应速率增大。但温度过高时反而导致降解反应速率减小,请从Fenton法所用试剂H2O2的角度分析原因:____________。
(4)实验③得出的结论是:pH等于10时,_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科学家设计二氧化碳熔盐捕获及电化学转化装置,其示意图如下:
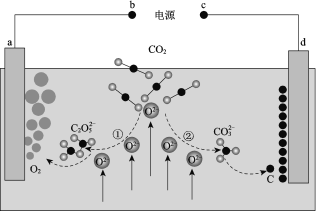
下列说法不正确的是
A. b为电源的正极
B. ①②中,捕获CO2时碳元素的化合价发生了变化
C. a极的电极反应式为2C2O52 4e == 4CO2 + O2
D. 上述装置存在反应:CO2 ===== C + O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,反应N2+3H22NH3,在2L密闭容器中进行,5min内氨的质量增加了1.7g,则反应速率为( )
A.v(H2)=0.03mol/(L·min)
B.v(N2)=0.02mol/(L·min)
C.v(NH3)=0.17mol/(L·min )
D.v(NH3)=0.01mol/(L·min)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某科研人员提出HCHO(甲醛)与O2在羟基磷灰石(HAP)表面催化生成H2O的历程,该历程示意图如下(图中只画出了 HAP的部分结构):

下列说法不正确的是
A. HAP能提高HCHO与O2的反应速率
B. HCHO在反应过程中,有C-H键发生断裂
C. 根据图示信息,CO2分子中的氧原子全部来自O2
D. 该反应可表示为:HCHO+O2![]() CO2+H2O
CO2+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在25 ℃时,用石墨电极电解2.0 L 0.5 mol·L-1CuSO4溶液。5 min后,在一个石墨电极上有6.4 gCu生成。试回答下列问题:
(1)发生氧化反应的________极,电极反应式为 ____________________________
(2)发生还原反应的________极,电极反应式为 ____________________________
(3)若将溶液恢复到与电解前一样,则需加入 ________ mol的________________。
(4)若用等质量的两块铜片代替石墨作电极,电解后两铜片的质量相差 ________________g,电解液的pH ________。(填“变小”、“变大”或“不变”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近日,科学家发表了高温二氧化碳电解发展报告,利用固体氧化物电解池将CO2和H2O转化为合成气并联产高纯度O2。原理如图所示。下列说法正确的是
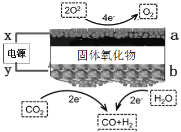
A.x极为电源正极
B.当有2 mol电子流向a极时,产生0.5 molO2
C.b极CO2的反应式:CO2+2H++2e-=CO+H2O
D.电解质中阴离子由a向b移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如表是不同温度下水的离子积数据:
温度 | 25 |
|
|
水的离子积常数 |
|
|
|
试回答以下问题:
![]() 若
若![]() ,则
,则![]() __________
__________![]() 填“
填“![]() ”、“
”、“![]() ”或“
”或“![]() ”
”![]() ,作出此判断的理由是__________。
,作出此判断的理由是__________。
![]() 下,某
下,某![]() 溶液中
溶液中![]() ,取该溶液
,取该溶液![]() ,加水稀释至
,加水稀释至![]() ,则稀释后溶液中
,则稀释后溶液中![]() span>__________。
span>__________。
![]() 下,将
下,将![]() 的苛性钠溶液
的苛性钠溶液![]() 与
与![]() 的稀硫酸
的稀硫酸![]() 混合
混合![]() 设混合后溶液的体积为原两溶液体积之和
设混合后溶液的体积为原两溶液体积之和![]() ,所得混合溶液的
,所得混合溶液的![]() ,则
,则![]() __________。此溶液中各种离子的浓度由大到小的排列顺序是__________________。
__________。此溶液中各种离子的浓度由大到小的排列顺序是__________________。
![]() 分别向等体积、相同pH的HCl溶液和
分别向等体积、相同pH的HCl溶液和![]() 溶液中加入足量的Zn粉,反应刚开始时产生
溶液中加入足量的Zn粉,反应刚开始时产生![]() 的速率:
的速率:![]() ______
______![]() 填“
填“![]() ”、“
”、“![]() ”或“
”或“![]() ”下同
”下同![]() ,反应完全后,所得氢气的质量:
,反应完全后,所得氢气的质量:![]() 盐酸_______
盐酸_______![]() 醋酸。
醋酸。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com