
| A. | 该反应中X为还原产物 | |
| B. | X能使溴水褪色,说明X具有漂白性 | |
| C. | 该反应中每生成1molFe2O3转移电子数约为6.02×1023 | |
| D. | 该反应生成的气体通入足量Ba(NO3)2溶液中,可得到两种沉淀 |
分析 由原子守恒配平方程式为:2FeSO4(s)$\frac{\underline{\;高温\;}}{\;}$SO2(g)+Fe2O3(s)+SO3(g)中Fe元素化合价升高,被氧化,S元素化合价降低,被还原,FeSO4既是氧化剂也是还原剂,结合元素化合价的变化解答该题.
解答 解:A.Fe元素化合价升高,被氧化,S元素化合价降低,被还原,SO2为还原产物,故A正确;
B.二氧化硫与溴水发生氧化还原反应,表现还原性,故B错误;
C.由方程式可知,反应中Fe元素化合价由+2价升高到+3价,该反应中每生成1molFe2O3转移2mol电子,电子数约为2×6.02×1023,故C错误;
D.该反应生成的气体通入足量BaCl2溶液中,生成硫酸钡沉淀,因硫酸盐酸酸性比亚硫酸强,则没有BaSO3生成,故D错误.
故选A.
点评 本题考查氧化还原反应,侧重二氧化硫的性质的考查,题目难度中等,本题注意SO3和SO2性质的区别,注意H2SO3酸性小于HCl和H2SO4,则不能与BaCl2溶液反应,得不到BaSO3沉淀.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 有氧化性,无还原性,无酸性 | B. | 无氧化性,有还原性,无酸性 | ||
| C. | 有氧化性,有还原性,有酸性 | D. | 无氧化性,有还原性,有酸性 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
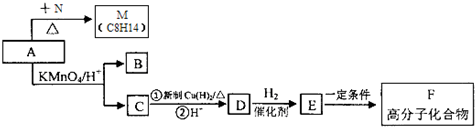
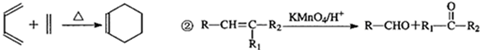
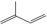 ,A与Br2按物质的量比l:l 发生加成反应,请写出生成的所有产物的结构简式为CH2BrCBr(CH3)CH=CH2、CH2=C(CH3)CHBrCH2Br、CH2BrC(CH3)=CHCH2Br(不考虑顺反异构).
,A与Br2按物质的量比l:l 发生加成反应,请写出生成的所有产物的结构简式为CH2BrCBr(CH3)CH=CH2、CH2=C(CH3)CHBrCH2Br、CH2BrC(CH3)=CHCH2Br(不考虑顺反异构). .
.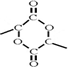 含有三元环:
含有三元环: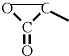 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
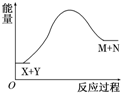
| A. | X的能量一定低于M的能量,Y的能量一定低于N的能量 | |
| B. | 因为该反应为吸热反应,故一定要加热反应才能进行 | |
| C. | 破坏反应物中的化学键所吸收的能量大于形成生成物中化学键所放出的能量 | |
| D. | 加入催化剂可增大正反应速率,降低逆反应速率 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 物质燃烧不一定是放热反应 | |
| B. | 放热反应一定不需要从外界吸收任何能量就能发生 | |
| C. | 化学反应除了生成新的物质外,还伴随着能量的变化 | |
| D. | 在一个确定的化学反应中,反应物总能量总是高于生成物总能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:X>Y>Z | |
| B. | 阴离子的还原性:W>X>Y | |
| C. | 气态氢化物的沸点:Y<W | |
| D. | 元素X与Z形成的两种化合物中,X的化合价相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaCl发生状态变化时,一定会破坏离子键 | |
| B. | 元素的非金属性越强,单质的活泼性一定越强 | |
| C. | 物质中分子间的作用力越大,分子越稳定 | |
| D. | 只含有共价键的物质一定是共价化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com