
| A、2 mol?L-1 |
| B、2.5 mol?L-1 |
| C、5 mol?L-1 |
| D、7.5 mol?L-1 |
| n |
| V |
| 0.5mol |
| 0.2L |


科目:高中化学 来源: 题型:
 (1)某温度下,纯水中的c(H+)=2.0×10-7mol/L,此时溶液的c(OH-)=
(1)某温度下,纯水中的c(H+)=2.0×10-7mol/L,此时溶液的c(OH-)=查看答案和解析>>
科目:高中化学 来源: 题型:
 已知:CO(g)+H2O(g)?CO2(g)+H2(g)△H=Q,其平衡常数随温度变化如下表所示:
已知:CO(g)+H2O(g)?CO2(g)+H2(g)△H=Q,其平衡常数随温度变化如下表所示:| 温度/℃ | 400 | 500 | 850 |
| 平衡常数 | 9.94 | 9 | 1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
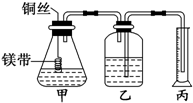 某研究性学习小组为证明在同温同压下,相同浓度、相同体积酸性不同的两种二元酸与足量镁带反应时,生成氢气的体积相同而反应速率不同,同时测定实验室条件下的气体摩尔体积.设计的简易实验装置如图所示.该实验的主要操作步骤如下:
某研究性学习小组为证明在同温同压下,相同浓度、相同体积酸性不同的两种二元酸与足量镁带反应时,生成氢气的体积相同而反应速率不同,同时测定实验室条件下的气体摩尔体积.设计的简易实验装置如图所示.该实验的主要操作步骤如下:查看答案和解析>>
科目:高中化学 来源: 题型:
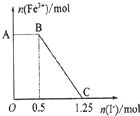 已知酸性高锰酸钾溶液可以将FeSO4氧化,MnO4-+5Fe2++8H+=Mn2++5Fe3++4H2O现将一定量酸性高锰酸钾溶液与硫酸亚铁溶液混合,充分反应后再向所得溶液中加入KI溶液,混合溶液中Fe3+的物质的量随加入KI的物质的量的变化关系如图所示.则下列说法不正确的是( )
已知酸性高锰酸钾溶液可以将FeSO4氧化,MnO4-+5Fe2++8H+=Mn2++5Fe3++4H2O现将一定量酸性高锰酸钾溶液与硫酸亚铁溶液混合,充分反应后再向所得溶液中加入KI溶液,混合溶液中Fe3+的物质的量随加入KI的物质的量的变化关系如图所示.则下列说法不正确的是( )| A、图中AB段主要是高锰酸钾和碘化钾溶液反应 |
| B、图中BC段发生的反应为2Fe3++2I-═2Fe2++I2 |
| C、根据OC段数据可知开始加入的高锰酸钾的物质的量为0.25 mol |
| D、根据OC段的数据可知开始加入的硫酸亚铁的物质的量为l mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、乙烯能发生加成反应,而乙烷不能发生加成反应 |
| B、乙醇与金属钠反应没有水与金属钠反应剧烈 |
| C、甲苯能使酸性高锰酸钾溶液褪色,而苯不能使酸性高锰酸钾溶液褪色 |
| D、苯酚能与NaOH溶液反应,而乙醇不能与NaOH溶液反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、通过品红溶液 |
| B、通过盐酸,再通过BaCl2溶液 |
| C、先通过NaOH溶液,再通过澄清石灰水 |
| D、先通过酸性KMnO4溶液,再通过澄清石灰水 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、碳在氧气中燃烧,n(C)/n(O2)与生成物的关系: |
B、分散系的分类与分散质粒直径大小关系: |
C、AlCl3和NaOH反应后铝元素的存在形式与反应物中n(OH-)/n(Al3+)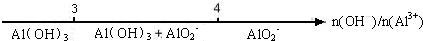 |
D、Na与O2反应的产物与反应物n(Na)/n(O2)的关系: |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com