
【题目】下列离子方程式能用来解释相应实验现象的是( )
A.氢氧化镁悬浊液中滴加氯化铵溶液,沉淀溶解:Mg(OH)2+2NH![]() =Mg2++2NH3·H2O
=Mg2++2NH3·H2O
B.沸水中滴加饱和氯化铁溶液得到红褐色液体:Fe3++3H2O=Fe(OH)3↓+3H+
C.用食醋能清洗水垢:CO![]() +2CH3COOH=2CH3COO-+H2O+CO2↑
+2CH3COOH=2CH3COO-+H2O+CO2↑
D.84消毒液与洁厕灵混用产生有毒气体:ClO-+Cl-+2H+=Cl2↑+OH-
 暑假作业海燕出版社系列答案
暑假作业海燕出版社系列答案科目:高中化学 来源: 题型:
【题目】草酸是一种重要的化工产品,实验室用硝酸氧化淀粉液水解制取草酸的装置如图所示(加热搅拌和仪器固定装置已略去)。
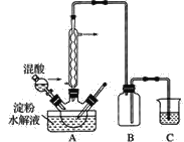
实验过程如下:
①将一定量的淀粉水解液加入三颈瓶中;
②控制反应液温度在55~60℃条件下,边搅拌边缓慢滴加一定量含有适量催化剂的混酸(65%HNO2与98%H2SO4的质量比为2∶1.5)溶液;
③反应3h左右,冷却、抽滤后再重结晶得草酸晶体。
硝酸氧化淀粉水解液过程中可发生下列反应:
C6H12O6+2HNO3→3H2C2O4+9NO2↑+3NO↑+9H2O
C6H12O6+8HNO3→6CO2↑+8NO↑+10H2O
3H2C2O4+2HNO3→6CO2↑+2NO↑+4H2O
回答下列问题:
(1)检验淀粉是否水解完全所需用的试剂为__。
(2)实验中若混酸滴加过快,将导致草酸产率下降,其原因是_。
(3)装置C用于尾气吸收,当尾气中n(NO2)∶n(NO)=1∶1时,过量的NaOH溶液能将NO全部吸收,原因是__(用化学方程式表示)。
(4)与用NaOH溶液吸收尾气相比较,若用淀粉水解液吸收尾气,其优、缺点是什么?__、__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢氧化锂(LiOH)是重要的初加T锂产品之一,可用于继续生产氟化锂、锰酸锂等,用天然锂辉石(主要成分LiAISi2O3,含有Fe (III)等杂质)生产LiOH的一种工艺流程如图所示:
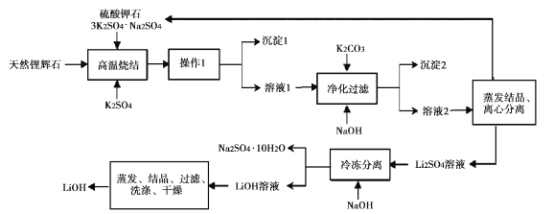
已知溶液1中含有Li+、K+、A13+、Na+、Fe3+、SO42-等离子,请回答相关问题。
(l)将LiAlSi2O6改写为氧化物的形式:____。
(2)高温烧结的目的是____。操作1是 __ 。
(3)净化过滤过程中溶液的pH不能过低也不能过高,原因是____。
(4)流程中的某种物质可循环利用,该物质的化学式是____。
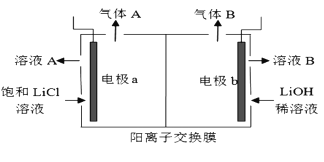
(5)工业生产中通过电解LiCI溶液的方法也可制得LiOH,其原理如图所示,电极a应连接电源的____(选填“正极”或“负极”),电极b发生的反应是 ___,阳离子交换膜的作用是___
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有反应:mA(g)+nB(g)![]() pC(g),达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数减小,则:
pC(g),达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数减小,则:
(1)该反应的逆反应为________反应(填“吸热”或“放热”),且m+n________p(填“>”、“=”或“<”)。
(2)减压使容器体积增大时,A的质量分数__________。(填“增大”、“减小”或“不变”,下同)
(3)若加入B(维持体积不变),则A的转化率____________。
(4)若升高温度,则平衡时B、C的浓度之比将____________。
(5)若加入催化剂,平衡时气体混合物的总物质的量__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在1 L的密闭容器中,发生反应4A(s)+3B(g)![]() 2C(g)+D(g),经2 min后B的浓度减少0.6 mol·L-1。对此反应速率的正确表示是( )
2C(g)+D(g),经2 min后B的浓度减少0.6 mol·L-1。对此反应速率的正确表示是( )
A. 用A表示的反应速率是0.4 mol·L-1·min-1
B. 用BCD分别表示反应的速率,其比值是3∶2∶1
C. 在第2 min末的反应速率用B表示是0.3 mol·L-1·min-1
D. 在这2 min内用B表示的速率的值逐渐减小,用C表示的速率的值逐渐增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应 C(s)+ H2O (g) ![]() CO (g)+H2 (g) △H>0 在某一时间段中反应速率与反应过程的曲线关系如图,下列说法正确的是( )
CO (g)+H2 (g) △H>0 在某一时间段中反应速率与反应过程的曲线关系如图,下列说法正确的是( )

A.CO的体积分数最高的一段时间为t5-t6
B.t2-t3和t3-t4时间段H2的体积分数相等
C.t1时刻改变的条件是降低温度
D.t4-t5时间段平衡向正反应方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】测定0.1mol·L-1Na2SO3溶液先升温再降温过程中的pH,数据如下表。实验过程中,取①、④时刻的溶液,加入盐酸酸化的BaCl2溶液做对比实验,④产生白色沉淀多。下列说法不正确的是( )
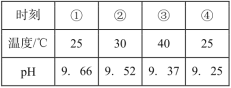
A.Na2SO3溶液中存在水解平衡:SO32-+H2O![]() HSO3-+OH-
HSO3-+OH-
B.④产生的白色沉淀是BaSO4
C.①→③的过程中,c(SO32-)在降低
D.①→③的过程中,温度与c(SO32-)相比,前者对水解平衡的影响更大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质制取的化学方程式中,不属于氧化还原反应的是( )
A.实验室制取氢气:Zn+H2SO4=ZnSO4+H2↑
B.实验室制取二氧化碳:CaCO3+2HCl=CaCl2+H2O+CO2↑
C.实验室制取氯气:MnO2+4HCl(浓)![]() MnCl2+2H2O+Cl2↑
MnCl2+2H2O+Cl2↑
D.工业上制取二氧化氯:2NaClO3+4HCl(浓)=2NaCl+2H2O+2ClO2↑+Cl2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外活动小组为了检验钠与水反应的产物,设计如图装置(夹持装置省略)。首先在U形管内加入少量煤油和几粒钠块,再从U形管高端加入水(含有酚酞),赶出空气,一段时间后加热铜丝。
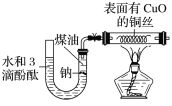
根据反应中观察到的现象,回答下列问题:
(1)金属钠的变化现象________。
(2)U形管中溶液的颜色_____,说明有__________生成。
(3)铜丝的变化现象____________,说明有________生成;若去掉后面的装置,简述检验气体的方法____
(4)若a g钠与b mL水完全反应,则该溶液溶质的质量分数是_______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com