
| A. | K+、NO3-、AlO2-、Na+ | B. | NH4+、SO42-、CO32-、NO3- | ||
| C. | Mg2+、Fe3+、Cl-、SCN- | D. | K+、Ca+、Cl-、HCO3- |
分析 与Al反应生成H2的透明溶液,为非氧化性酸或强碱溶液,根据离子之间不能结合生成沉淀、气体、水等,不能发生氧化还原反应、络合反应等,则离子大量共存,以此来解答.
解答 解:与Al反应生成H2的透明溶液,为非氧化性酸或强碱溶液,
A.碱性溶液中该组离子之间不反应,可大量共存,故A选;
B.碱性溶液中不能大量存在NH4+,酸性溶液中不能大量存在CO32-,故B不选;
C.碱性溶液中不能大量存在Mg2+、Fe3+,Fe3+、SCN-结合生成络离子,不能共存,故C不选;
D.酸碱溶液中不能大量存在HCO3-,故D不选;
故选A.
点评 本题考查离子共存,为高频考点,把握习题中的信息及常见离子之间的反应为解答的关键,侧重分析与应用能力的考查,注意复分解反应、氧化还原反应的判断,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,11.2L的CHCl3所含的分子数为0.5NA | |
| B. | 17g羟基(-OH)所含有的电子数是10NA | |
| C. | 9.2g甲苯和丙三醇的混合物中,含氢原子数目为0.8NA | |
| D. | 现有乙烯、丙烯的混合气体共28g,其中碳原子数为3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
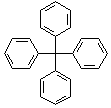 甲烷分子中的4个氢原子全部被苯基取代,可得如图所示的分子,对该分子的描述不正确的是( )
甲烷分子中的4个氢原子全部被苯基取代,可得如图所示的分子,对该分子的描述不正确的是( )| A. | 分子式为C25H20 | |
| B. | 所有碳原子可能在同一平面上 | |
| C. | 该化合物分子一定处于同一平面的原子至少有12个 | |
| D. | 分子中可能处于同一平面的原子最多有23个 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaCl NaBr NaI | B. | NaCl NaBr | C. | NaCl NaI | D. | NaCl |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 加入的物质 | 结论 | |
| A | 0.05molCH3COONa | $\frac{c(C{H}_{3}CO{O}^{-})}{c(N{a}^{+})}$增大 |
| B | 0.05molNaHSO4 | c(CH3COO-)+c(CH3COOH)=c(Na+)-c(SO42-) |
| C | 0.05molNH4Cl | 溶液中性,水的电离程度减小 |
| D | 50mLH2O | 由水电离出的c(H+)•c(OH-)减小 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | R的气态氢化物的水溶液具有强酸性 | |
| B. | 常温下,能稳定存在的R的氧化物都是酸性氧化物 | |
| C. | R是金属元素 | |
| D. | R的气态氢化物不能在氧气中燃烧 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com