
����Ŀ��������ij��ѧ��ȤС��Ҫ����к��ȵIJⶨ��
��1��ʵ�����ϱ��д�С�����ձ�����ĭ���ϡ���ĭ���ϰ塢��ͷ�ιܡ����β����������0.5 mol��L-1���ᡢ0.55 mol��L-1NaOH��Һ,ʵ����ȱ�ٵIJ�����Ʒ��____��____��
��2��ʵ�����ܷ��û���ͭ˿��������滷�β��������?____(����������������),��ԭ����______________________________________________________________��
��3�����Ǽ�¼��ʵ����������:
ʵ����Ʒ | ��Һ�¶� | �к��� | |||
t1 | t2 | ��H | |||
�� | 50 mL 0.55 mol��L-1 NaOH��Һ | 50 mL 0.5 mol��L-1 HCl��Һ | 20 �� | 23.3 �� | |
�� | 50 mL 0.55 mol��L-1 NaOH��Һ | 50 mL 0.5 mol��L-1 HCl��Һ | 20 �� | 23.5 �� | |
��֪:Q=cm(t2-t1),��Ӧ����Һ�ı�����cΪ4.18 kJ����-1��kg-1,�����ʵ��ܶȾ�Ϊ1 g��cm-3��
�ټ�������ϱ��е���H��
��4������KOH����NaOH,�Բⶨ���____(����������������)Ӱ��;���ô������HCl��ʵ��,�Բⶨ���____(����������������)Ӱ�졣
����������һ���¶��£���2 mol N2��6 mol H2ͨ��һ�����������ܱ����� �У�������ͼ ���������з������µķ�Ӧ��N2��g��+3 H2��g��
���������з������µķ�Ӧ��N2��g��+3 H2��g��![]() 2NH3 ��g�� ������ӦΪ���ȷ�Ӧ��������Ӧ�ﵽƽ���û������Ϊ7 mol ���ݴ˻ش��������⣺����������Ӧ�¶Ȳ��䣬ʹa��b��c�ֱ������ʼ�����N2��H2��NH3�����ʵ����������Ӧ�ﵽƽ����������и����ʵ����ʵ���������������ƽ��ʱ��ȫ��ͬ����ô��
2NH3 ��g�� ������ӦΪ���ȷ�Ӧ��������Ӧ�ﵽƽ���û������Ϊ7 mol ���ݴ˻ش��������⣺����������Ӧ�¶Ȳ��䣬ʹa��b��c�ֱ������ʼ�����N2��H2��NH3�����ʵ����������Ӧ�ﵽƽ����������и����ʵ����ʵ���������������ƽ��ʱ��ȫ��ͬ����ô��
��1����a=1 mol ��c=2 mol����b=____ mol���ڴ�����£���Ӧ��ʼʱ����___������У��� ������Ӧ����������Ӧ����
��2�����涨��ʼʱ��Ӧ���淴Ӧ������У���c�ķ�Χ��_____��
��3��������װ���У��������ƽ���Ļ����������ʵ���Ϊ6.5 mol����ɲ�ȡ�Ĵ�ʩ��_________
��III������ͼ��ʾ���¶Ȳ���ʱ����ij�����ָ��A��B�����֣�A��������̶����䣬B�пɶ��Ļ���������A�г���2 mol SO2��1 mol O2,��B�г���2 mol SO3�� 1 mol N2������ͬ�����·������淴Ӧ��2 SO2��g��+O2��g�� ![]() 2 SO3��g������������Ҫ����д�հף�
2 SO3��g������������Ҫ����д�հף�

��1���̶�����λ����3���������ﵽƽ��ʱ����A��ѹǿΪPA,B��ѹǿΪPB����PA��PB�Ĺ�ϵ��PA_______PB(����<������=������>��)��
��2����ҪʹA��B��ƽ��״̬��ͬ�����ƶ�������λ��Ӧ��____����
��3�����������Ƶ�5�����ﵽƽ���B��SO3Ϊxmol,A��SO3Ϊymol, ��x��y �Ĺ�ϵ��x____y. (����<������=������>��)��
���𰸡� ��Ͳ �¶ȼ� ��������������,����ɢʧ�������� ![]() kJ��mol-1 �� �� 3 �淴Ӧ 1
kJ��mol-1 �� �� 3 �淴Ӧ 1![]() c
c![]() 4 �������10�������¶� < 3 <
4 �������10�������¶� < 3 <
��������������������⿼���к��ȵIJⶨ����Чƽ����ɵ�Ӧ�ã���������Ի�ѧƽ���Ӱ�죬��ѧƽ��ļ��㡣
��I����1�������к��ȵIJⶨ����Ҫ�IJ�����ƷΪ����Ͳ���¶ȼƣ���Ͳ������ȡ�����NaOH��Һ��������¶ȼ����ڲ�����Ӧǰ����¶ȡ�
��2�������û���ͭ˿��������滷�β������������ΪCuΪ�������������ȣ�����ɢʧ��������
��3��������ʵ����¶Ȳ�Ϊ23.3��-20��=3.3����������ʵ����¶Ȳ�Ϊ23.5��-20��=3.5�棬����ʵ���ƽ���¶Ȳ�Ϊ![]() =3.4�棬��Ӧ�ų�������Q=cm(t2-t1)=4.18 kJ����-1��kg-1
=3.4�棬��Ӧ�ų�������Q=cm(t2-t1)=4.18 kJ����-1��kg-1![]() ��1 g��cm-3
��1 g��cm-3![]() 50mL+1 g��cm-3
50mL+1 g��cm-3![]() 50mL��
50mL��![]() 10-3kg/g
10-3kg/g![]() 3.4��=1.4212kJ����Ӧ���ɵ�H2O�����ʵ���Ϊ��n��H2O��=n��HCl��=0.5mol/L
3.4��=1.4212kJ����Ӧ���ɵ�H2O�����ʵ���Ϊ��n��H2O��=n��HCl��=0.5mol/L![]() 0.05L=0.025mol���к��Ȧ�H=-
0.05L=0.025mol���к��Ȧ�H=-![]() =-56.85kJ/mol��
=-56.85kJ/mol��
��4������KOH����NaOH��KOH��NaOH������ǿ��ˮ��Һ���Բⶨ�����Ӱ�졣���ô������HCl��ʵ�飬�����������ᣬ����������ȣ��Բⶨ�����Ӱ�죬ʹ��õ��к�����Hƫ��
��II��������ʽ���㣬�����ʼ��ƽ��ת��N2���ʵ���Ϊxmol��
N2��g��+3 H2��g��![]() 2NH3 ��g��
2NH3 ��g��
n����ʼ����mol�� 2 6 0
n��ת������mol�� x 3x 2x
n��ƽ�⣩��mol�� 2-x 6-3x 2x
��2-x+6-3x+2x=7mol�����x=0.5��ƽ��ʱN2��H2��NH3���ʵ�������Ϊ1.5mol��4.5mol��1mol������������Ӧ�¶Ȳ��䣬ʹa��b��c�ֱ������ʼ�����N2��H2��NH3�����ʵ����������Ӧ�ﵽƽ����������и����ʵ����ʵ���������������ƽ��ʱ��ȫ��ͬ����ʱ��ƽ����ԭƽ��Ϊ���º����·�Ӧǰ��������������ȵĵ�Чƽ�⣬���ݵ�Чƽ��Ĺ��ɣ����ü�����һ�ߵ���������������ʵ���Ӧ�ֱ��Ӧ��ȣ�a+![]() =2��b+
=2��b+![]() =6��
=6��
��1����a=1 mol��c=2 mol����b=3mol����ʼN2��H2���ʵ���С��ƽ��ʱ��NH3���ʵ�������ƽ��ʱ����Ӧ��ʼʱ�����淴Ӧ���������
��2�����涨��ʼʱ��Ӧ���淴Ӧ������У���Ӧ��ȡ��Сֵa=0��b=0����c�����ֵΪ4����Ӧ���淴Ӧ������У���NH3����ʼֵ����ƽ��ֵ��c![]() 1��c�ķ�Χ��1
1��c�ķ�Χ��1![]() c
c![]() 4��
4��
��3���÷�Ӧ������ӦΪ�����������С�ķ�Ӧ��������װ���У��������ƽ������������ʵ���Ϊ6.5mol![]() 7mol����ʹƽ��������Ӧ�����ƶ����ɲ�ȡ�Ĵ�ʩ�ǽ����¶ȡ�
7mol����ʹƽ��������Ӧ�����ƶ����ɲ�ȡ�Ĵ�ʩ�ǽ����¶ȡ�
��III��N2�뷴Ӧ�أ����Ȳ�����N2�����̶�����λ����3����������A��BΪ���º���������A����ʼ����2molSO2��1molO2��B����ʼ����2molSO3�����ü�����һ�ߵ������൱��2molSO2��1molO2����A����ȫһ�£���A��Bƽ��ʱΪ��ȫȫ�ȵĵ�Чƽ�⣬��ƽ��ʱ���������ֱ��Ӧ��ȡ�
��1�����������������̶�����λ����3��������������B�е�N2����A��B�ﵽƽ��ʱѹǿ�����B����ƽ��ʱ�ټ���1molN2����ѧƽ�ⲻ�ƶ�����N2Ҳ����ѹǿ��B��ѹǿ������ƽ��ʱPA![]() PB��
PB��
��2����������������ҪʹA��B��ƽ��״̬��ͬ�ƶ�������λ����3����
��3��������3��ʱA��B��SO3���ʵ�����������������Ƶ�5��������B��3�Ƶ�5�������������Сѹǿ��ƽ�����淴Ӧ�����ƶ�����x![]() y��
y��
�����ص�ͷ�Ӧ�ص� | ��Ч���� | ��� |
���º��� ��Ӧǰ���������������� | ��ʼͶ�ϻ������ͬ���ʱ�ʾʱ���ʵ�����Ӧ��� | ����ƽ��ʱ����ְٷֺ�����n��c��p����ͬ |
���º��� ��Ӧǰ�������������� | ��ʼͶ�ϻ������ͬ���ʱ�ʾʱ���ʵ�����Ӧ�ɱ��� | ����ƽ��ʱ����ְٷֺ�����ͬ��n��c��p�ɱ����仯 |
���º�ѹ �������������Ŀ��淴Ӧ | ��ʼͶ�ϻ������ͬ���ʱ�ʾʱ���ʵ�����Ӧ�ɱ��� | ����ƽ��ʱ����ְٷֺ�����c��ͬ��n��V�ɱ����仯 |


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʵ������������
A. ����ʱ��Ӧʹ�¶ȼ�ˮ����������ƿ֧�ܿ�
B. ��Һʱ����Һ©�����²�Һ����¿ڷų����ϲ�Һ����Ͽڵ���
C. ����һ�����ʵ���Ũ�ȵ���Һʱ������ˮ�����̶ȣ�Ӧ�������ơ�
D. �����þƾ���ȡ��ˮ�еĵ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����C2H2��C6H6��C2H4O��ɵĻ�����У���֪��Ԫ�ص���������Ϊ8%����������̼Ԫ�ص����������ǣ� ��
A.92.3%
B.87.6%
C.75%
D.84%
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����л����ķ����ᴿ������ȷ����
A. ����ֲ���ͺ�ˮ������
B. �����Ҵ���ˮ����Һ
C. ���Ȼ��ƺ͵�(���߲���Ӧ)���ˮ��Һ�еõ��⣺��ȡ����Һ������
D. ��ȥ�Ȼ��ƹ����е���������أ��ܽ⡢���ˡ�ϴ�ӡ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ӷ���ʽ��������ʵ�������ȷ����
A. Ca(HCO3)2��Һ�м�������NaOH��Һ��Ca2����2HCO3����2OH����CaCO3����CO32����2H2O
B. ����0.4molFeBr2����Һ��ͨ��0.3molCl2��ַ�Ӧ�� 4Fe2����2Br����3Cl2��4Fe3����6Cl����Br2
C. �ö��Ե缫���MgCl2��Һ��2Cl����2H2O![]() 2OH����Cl2����H2��
2OH����Cl2����H2��
D. ��������������ϡ������Fe3O4��8H����NO3����3Fe3����NO����4H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������������Ӧ��ʱ����ԭ�����õ��ǣ� ��
A.��������ˮ��B.������������ʪ��
C.Ư����������D.������ʳƷ���ڵ�������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����2.5g̼���ơ�̼�����ƺ��������ƵĹ���������ȫ�ܽ���ˮ���Ƴ�ϡ��Һ��Ȼ�������Һ����μ���1molL��1�����ᣬ�������������������CO2���������״������ϵ��ͼ��ʾ�� 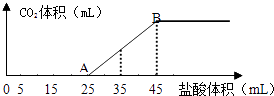
��1��д��OA����������Ӧ�����ӷ���ʽ�� ��
��2��������45mL����ʱ������CO2�����ΪmL����״������
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com