
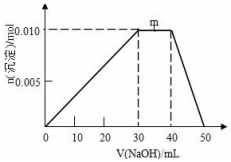
 向盛有10mL1mol•L-1 NH4Al(SO4)2溶液的烧杯中滴加1mol•L-1NaOH溶液,沉淀物质的量随NaOH溶液体积变化示意图如下:
向盛有10mL1mol•L-1 NH4Al(SO4)2溶液的烧杯中滴加1mol•L-1NaOH溶液,沉淀物质的量随NaOH溶液体积变化示意图如下:分析 ①由图可知加氢氧化钠0mL~30mL,氢氧化铝沉淀增多,m点过程中加入氢氧化钠,沉淀的量不变,生成NH3•H2O,40mL~50mL是氢氧化铝逐渐溶解;
②根据n=cV计算n(Al3+ )、n(NH4+)、n(SO42-)、n(Ba2+)、n(OH-),根据SO42-、Ba2+中不足量的离子的物质的量计算生成BaSO4的物质的量,依次发生:Al3++3OH-=Al(OH)3↓、NH4++OH-=NH3•H2O、Al(OH)3+OH-=AlO2-+2H2O,根据方程式计算生成Al(OH)3的物质的量,进而计算生成固体总物质的量.
解答 解:①由图可知0mL~30mL,发生反应Al3++3OH-=Al(OH)3↓,氢氧化铝沉淀逐渐增多,m点过程中加入氢氧化钠,沉淀物质的量不变,是NH4+与OH-反应生成NH3•H2O,离子方程式为:NH4++OH-=NH3•H2O,40mL~50mL是氢氧化铝逐渐溶解,
故答案为:NH4++OH-=NH3•H2O;
②10mL 1mol•L-1 NH4Al(SO4)2溶液中Al3+ 物质的量为0.01mol,NH4+的物质的量为0.01mol,SO42-的物质的量为0.02mol,20mL 1.2 mol•L-1Ba(OH)2溶液中Ba2+物质的量为0.024mol,OH-为0.048mol,
由SO42-+Ba2+=BaSO4↓,可知SO42-不足,故可以得到0.02mol BaSO4,
Al3++3OH-=Al(OH)3↓
0.01mol 0.03mol 0.01mol
反应剩余OH-为0.048mol-0.03mol=0.018mol,
NH4++OH-=NH3•H2O
0.01mol 0.01mol
反应剩余OH-为0.018mol-0.01mol=0.008mol,
Al(OH)3+OH-=AlO2-+2H2O
0.008mol 0.008mol
故得到Al(OH)3沉淀为0.01mol-0.008mol=0.002mol
则最终得到固体为0.02mol+0.002mol=0.022mol,
故答案为:0.022.
点评 本题考查化学图象及离子方程式的计算,是对学生综合能力的考查,需要学生具备扎实的基础,明确离子反应的先后顺序是解题的关键,难度中等.


 口算小状元口算速算天天练系列答案
口算小状元口算速算天天练系列答案科目:高中化学 来源: 题型:选择题
| A. | 简单的离子半径:W>Z>Y>X | |
| B. | 五种元素中只有X存在同素异形体 | |
| C. | W和M形成的化合物是离子化合物 | |
| D. | 工业上采用电解W和Z形成的化合物制备W单质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | a>b | B. | a<b | C. | a=b | D. | 无法确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 精铜板作阴极,纯铜片作阳极,CuSO4溶液作电解液 | |
| B. | 电解时,阴极发生氧化反应,则阴极发生的反应为:Cu2++2e-═Cu | |
| C. | 粗铜中所含Ni、Fe、Zn等金属杂质,电解后以单质形式沉积槽底,形成阳极泥 | |
| D. | 电解铜的纯度可达99.95%~99.98% |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com