
| A. | 漂白粉使某些有色染料褪色 | |
| B. | 一氧化氮气体暴露在空气中变为红棕色 | |
| C. | 往黄色氯化铁溶液中投入铁粉,溶液颜色变浅 | |
| D. | 往红墨水中投入活性炭,红色褪去 |
分析 A.漂白粉具有强氧化性,使有色物质褪色;
B.NO被氧化生成二氧化氮;
C.氯化亚铁溶液为浅绿色;
D.活性炭具有吸附性,可使有色物质褪色.
解答 解:A.漂白粉具有强氧化性,使有色物质褪色,则漂白粉使某些有机颜料褪色,与氧化还原反应有关,故A不选;
B.NO被氧化生成二氧化氮,则一氧化氮气体在空气中变为红棕色,与氧化还原反应有关,故B不选;
C.铁具有还原性,三氯化铁具有氧化性,三氯化铁与铁反应生成浅绿色的氯化亚铁,发生了化学反应,故C不选;
D.活性炭具有吸附性,可使有色物质褪色,则向红墨水中投入活性炭,红色褪去,与吸附性有关,为物理性质,故D选;
故选D.
点评 本题考查物质的性质及应用,为高频考点,把握物质的性质、发生的反应、具有漂白性的物质、漂白原理为解答的关键,侧重分析与应用能力的考查,注意元素化合物知识的应用,题目难度不大.


 考前必练系列答案
考前必练系列答案科目:高中化学 来源: 题型:选择题
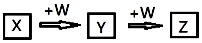 X、Y、Z、W均为中学化学中常见物质,一定条件下它们之间有如图转化关系(其它产物已略去):下列说法不正确的是( )
X、Y、Z、W均为中学化学中常见物质,一定条件下它们之间有如图转化关系(其它产物已略去):下列说法不正确的是( )| A. | 若W是强氧化性的单质,则X可能是金属铝 | |
| B. | 若W是氢氧化钠,则X水溶液为酸性 | |
| C. | 若W是单质铁,则Z溶液可能是FeCl2溶液 | |
| D. | 若W是氧气,则X、Z的相对分子质量可能相差48 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 时间/s | 0 | 1 | 2 | 3 | 4 |
| C(NO)/mol•L-1 | 9.50×10-3 | 4.50×10-3 | 2.50×10-5 | 1.50×10-3 | 1.5×10-3 |
| C(CO)/mol•L-1 | 9.00×10-3 | 4.00×10-3 | 2.00×10-3 | 1.00×10-3 | 1.00×10-3 |
| A. | -定温度下,从开始到平衡,该反应的平衡常数逐渐增大 | |
| B. | 前2s内的平均反应速率v(N2)=1.75×10-3 mol•L-1•s-1 | |
| C. | 达到平衡时,CO的转化率为11.11% | |
| D. | 3s时NO和CO的浓度都不再变化,反应停止进行 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH3易液化,氨常用作制冷剂 | |
| B. | 胆矾遇浓硫酸变白是因为浓硫酸的脱水性 | |
| C. | 氨催化氧化制硝酸过程中的三个主要反应都属于氧化还原反应 | |
| D. | 浓硝酸需保存在棕色瓶中 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol乙烯和乙醇的混合物完全燃烧时消耗O2的分子数为3NA | |
| B. | 1.5 mol Na2O和Na2O2的混合物中离子数目为4.5 NA | |
| C. | 标准状况下,11.2 L HF中含有的分子数为0.5NA | |
| D. | 常温常压下,17 g 羟基含有的电子总数为9 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
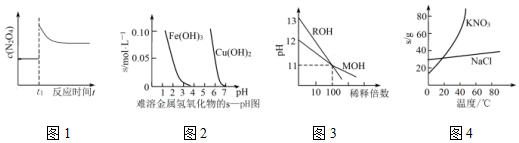
| A. | 图1表示平衡2NO2(g)?N2O4(g)在t1时迅速将体积缩小后c(N2O4)的变化 | |
| B. | 图2表示除去CuSO4溶液中的Fe3+可采用加入CuO调节溶液pH到4~5 | |
| C. | 图3表示MOH和ROH两种一元碱的溶液分别加水稀释时的pH变化,则碱性:MOH>ROH | |
| D. | 图4为KNO3和NaCl溶解度曲线,若除去NaCl中少量的KNO3,可在较高温度下制得浓溶液后,再冷却结晶、过滤、洗涤、干燥得纯净NaCl |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 操作 | 结论 |
| A | 向溶液X 中加入稀盐酸和氯化钡的混合溶液, 出现白色沉淀 | 说明溶液X 中一定含有SO42- |
| B | 向盛有Fe(NO3)2溶液的试管中加入1mol•L-1 的H2SO4 | 若试管口出现红棕色气体,说明 NO3-被Fe2+还原为NO2 |
| C | 制备乙酸乙酯的实验,将蒸出的乙酸乙酯蒸气 导在饱和的NaOH溶液液面以上 | 防止倒吸,便于分层. |
| D | 使用含 NaF 的牙膏,可以使牙齿上的 Ca5(PO4)3OH转化为Ca5(PO4)3F,防止蛀牙 | Ksp[Ca5(PO4)3F]<Ksp[Ca5(PO4)3 OH] |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com