

分析 用天青石矿(主要成分为SrSO4)生产高纯度碳酸锶,须除去碳酸锶粗品中的Ca2+、Ba2+、Fe2+和Mg2+,在饱和碳酸氢铵溶液中溶解,放出二氧化碳,过滤得到滤渣加入盐酸酸溶,调节溶液PH=1.0,过滤得到沉淀中加入0.1%的硫酸,过滤得到滤液加入NaClO3氧化亚铁离子,调节溶液PH沉淀铁离子,过滤得到滤液中加入20%烧碱沉淀镁离子和钙离子,过滤得到滤液中加入饱和碳酸氢铵碳酸化得到碳酸锶过滤洗涤干燥得到固体,
(1)天青石溶解过程生成SrCO3粗品,同时发出二氧化碳气体、硫酸铵和水;矿石粉碎增大接触面积提高反应速率;
(2)盐酸酸化是溶解碳酸锶生成锶离子、二氧化碳和水;
(3)加入硫酸沉淀钡离子生成硫酸钡沉淀,硫酸浓度过大会沉淀锶离子;
(4)氯酸钠是氧化剂氧化亚铁离子生成氢氧化铁和盐酸,结合电荷守恒和原子守恒配平书写离子方程式;
(5)滤渣Ⅱ为氢氧化钙、氢氧化镁沉淀,加入20%的烧碱溶液时需将温度控制在90℃为佳,氢氧化钙溶解度随温度升高减小;
解答 解:用天青石矿(主要成分为SrSO4)生产高纯度碳酸锶,须除去碳酸锶粗品中的Ca2+、Ba2+、Fe2+和Mg2+,在饱和碳酸氢铵溶液中溶解,放出二氧化碳,过滤得到滤渣加入盐酸酸溶,调节溶液PH=1.0,过滤得到沉淀中加入0.1%的硫酸,过滤得到滤液加入NaClO3氧化亚铁离子,调节溶液PH沉淀铁离子,过滤得到滤液中加入20%烧碱沉淀镁离子和钙离子,过滤得到滤液中加入饱和碳酸氢铵碳酸化得到碳酸锶过滤洗涤干燥得到固体,
(1)天青石溶解过程生成SrCO3粗品,同时发出二氧化碳气体、硫酸铵和水,反应的化学方程式为:SrSO4+2NH4HCO3=SrCO3+(NH4)2SO4+CO2↑+H2O;矿石粉碎增大接触面积提高反应速率,
故答案为:SrSO4+2NH4HCO3=SrCO3+(NH4)2SO4+CO2↑+H2O;增大矿石与溶液的接触面积提高反应速率;
(2)盐酸酸化是溶解碳酸锶生成锶离子、二氧化碳和水,反应的离子方程式为:SrCO3+2H+=Sr2++CO2↑+H2O,
故答案为:SrCO3+2H+=Sr2++CO2↑+H2O;
(3)加入硫酸沉淀钡离子生成硫酸钡沉淀,滤渣Ⅰ的主要成分是硫酸钡,硫酸的浓度不能超过0.1%的原因是硫酸浓度过大会沉淀锶离子,
故答案为:BaSO4;防止生成SrSO4沉淀,减少锶元素的损失;
(4)氯酸钠是氧化剂氧化亚铁离子生成氢氧化铁和盐酸,结合电荷守恒和原子守恒配平书写离子方程式ClO3-+6Fe2++15H2O=6Fe(OH)3+Cl-+12H+,
故答案为:ClO3-+6Fe2++15H2O=6Fe(OH)3+Cl-+12H+;
(5)滤渣Ⅱ为氢氧化钙、氢氧化镁沉淀,加入20%的烧碱溶液时需将温度控制在90℃为佳,氢氧化钙溶解度随温度升高减小,所以升温降低了氢氧化钙溶解度有利于沉淀析出,
故答案为:Mg(OH)2和Ca(OH)2;降低Ca(OH)2溶解度,有利于沉淀析出;
点评 本题考查了物质的分离提纯、生产流程的分析判断,主要是物质的性质、试剂选择的目的和沉淀产物的理解应用,掌握基础是解题关键,题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
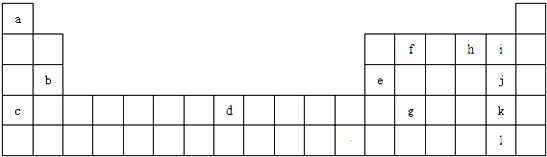
| A. | ③⑥①②⑤④ | B. | ⑤①②⑥④③ | C. | ⑤④③②①⑥ | D. | ③①②④⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 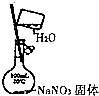 配置一定物质的量 浓度的NaNO3溶液 | |
| B. | 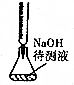 中和滴定 | |
| C. | 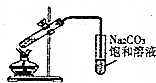 制备乙酸乙酯 | |
| D. | 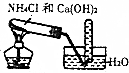 实验室制取氨 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碱性:KOH>NaOH | B. | Mg、Al与同浓度盐酸反应,Mg更剧烈 | ||
| C. | 稳定性:HBr>HI | D. | 酸性:H3PO4>HNO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 粗铜精炼时,与电源正极相连的是纯铜,阳极反应式为Cu-2e-═Cu2+ | |
| B. | 氢氧燃料电池的负极反应式:O2+2H2O+4e-═4OH- | |
| C. | 用惰性电极电解饱和食盐水时,阳极的电极反应式为2Cl--2e-═Cl2↑ | |
| D. | 钢铁发生电化学腐蚀的正极反应式:Fe-2e-═Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | A是非电解质 | B. | A是强电解质 | C. | A是共价化合物 | D. | A是弱电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
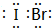 ,它是由σ键形成的(根据原子轨道的重叠程度填写).
,它是由σ键形成的(根据原子轨道的重叠程度填写).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
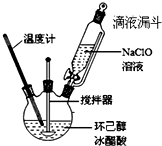 环己酮是重要的化工原料,也是重要的工业溶剂,实验室常用次氯酸氧化法制备环己酮.
环己酮是重要的化工原料,也是重要的工业溶剂,实验室常用次氯酸氧化法制备环己酮.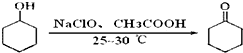
| 物质 | 熔点(℃) | 沸点(℃) | 溶解性 |
| 环己醇 | 26 | 160.8 | 可溶于水 |
| 环己酮 | -45 | 155.6 | 微溶于水 |
| 冰醋酸 | 16.6 | 117.9 | 可溶于水 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com