
【题目】用如图所示装置(夹持仪器已略去)探究铜与过量浓硫酸的反应。下列实验不合理的是

A. 为确认CuSO4生成,直接向①中加水,观察颜色
B. ②中选用品红溶液验证SO2的生成
C. ③中选用NaOH溶液吸收多余的SO2
D. 上下移动①中铜丝可控制SO2的量
【答案】A
【解析】浓硫酸具有强氧化性,在加热条件下与铜发生氧化还原反应生成硫酸铜、二氧化硫和水,其反应的方程式为:Cu+2H2SO4(浓)![]() CuSO4+SO2↑+2H2O;二氧化硫具有漂白性,能使品红褪色,当②中品红溶液褪色,说明反应中生成二氧化硫;③中选用NaOH溶液吸收多余的SO2;硫酸铜溶于水溶液显蓝色,要检验生成物中有硫酸铜,则熄灭酒精灯并使①中溶液冷却到室温,将①中溶液缓慢地加入到装有水的烧杯中,并不断搅拌,溶液呈蓝色;
CuSO4+SO2↑+2H2O;二氧化硫具有漂白性,能使品红褪色,当②中品红溶液褪色,说明反应中生成二氧化硫;③中选用NaOH溶液吸收多余的SO2;硫酸铜溶于水溶液显蓝色,要检验生成物中有硫酸铜,则熄灭酒精灯并使①中溶液冷却到室温,将①中溶液缓慢地加入到装有水的烧杯中,并不断搅拌,溶液呈蓝色;
A项,反应后溶液呈蓝色,且不能直接向浓硫酸中加水,应取铜与浓硫酸反应后①中溶液,滴入水中,边加边搅拌,溶液显蓝色即可证明有CuSO4生成,故A项错误;
B项,SO2可使品红溶液褪色(化合作用),因此②中品红溶液可以验证SO2的生成,故B项正确;
C项,SO2有毒,能与NaOH溶液反应,因此③中NaOH溶液可以吸收多余的SO2,故C项正确。
D项,上下移动铜丝可以控制铜与浓硫酸的接触面积的大小,从而可以控制反应生成SO2的量,故D项正确;
综上所述,本题正确答案为A。


科目:高中化学 来源: 题型:
【题目】下列有关物质的分类正确的是
A.混合物:空气、矿泉水、水银B.酸性氧化物:CO2 、SO2、 CO
C.盐:醋酸钠、氯化铵、纯碱D.电解质:CH3COOH、H2O、NH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜锌合金的颜色酷似金的颜色,所以近来用铜锌合金制成的假金元宝欺骗行人的事件屡有发生。要检验市面上的金首饰是否为纯金或者真金,可取样品与一种试剂进行反应,根据现象即可判断,所取的试剂是(王水是3份浓盐酸和1份浓硝酸的混合物)( )
A.硫酸B.“王水”C.盐酸D.硝酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于可逆反应N2(g)+3H2(g)2NH3(g)△H<0,下列研究目的和示意图相符的是( )
A | B | C | D | |
研究目的 | 压强对反应的影响(P2>P1) | 温度对反应的影响 | 平衡体系增加N2对反应的影响 | 催化剂对反应的影响 |
图示 |
|
|
|
|
A.A
B.B
C.C
D.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F六种元素位于短周期,原子序数依次增大,C基态原子核外有三个未成对电子,B与D形成的化合物BD与C的单质C2电子总数相等,CA3分子结构为三角锥形,D与E可形成E2D与E2D2两种离子化合物,D与F是同族元素.
根据以上信息,回答下列有关问题:
(1)写出基态时D的电子排布图 .
(2)写出化合物E2F2的电子式 , 化合物ABC的结构式 .
(3)根据题目要求完成以下填空:
BF32﹣中心原子杂化方式;D3中心原子杂化方式;
FD42﹣微粒中的键角;FD3分子的立体构型 .
(4)根据等电子原理,指出与BD2互为等电子体且含有C原子的微粒有、(要求写一种分子和一种离子).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“达菲”瑞士罗氏制药公司生产的一种治疗禽流感和甲型H1N1流感(猪流感)的特效药.达菲的主要有效成分莽草酸是从中国百姓常见的调味料八角茴香中提取出来的.莽草酸的结构式如图,下列说法正确的是( )
A.它能使溴水褪色
B.遇FeCl3溶液呈紫色
C.它不能发生消去反应
D.1mol莽草酸跟足量的钠反应可以得到4molH2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组同学进行如下实验,以探究化学反应中的能量变化。
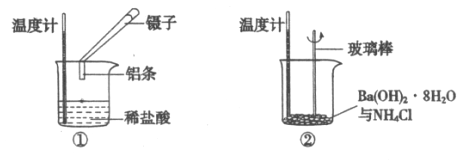
(1)实验表明:②中的温度降低,由此判断氢氧化钡晶体与氯化铵晶体反应是____________(填“吸热”或“放热”)反应。
(2)实验①中,该小组同学在烧杯中加入5 mL 1.0 mol/L盐酸,再放入用砂纸打磨过的铝条,观察产生H2的速率,如图A所示,该反应是________(填“吸热”或“放热”)反应,其能量变化可用下图中的___________(填“B”或“C”)表示。

A中0—t1段化学反应速率变化的原因是__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】pH=1的某溶液X中仅含有NH4+、Al3+、Ba2+、Fe2+、Fe3+、CO32﹣、SO32﹣、SO42﹣、Cl﹣、NO3﹣中的一种或几种(忽略水的电离及离子的水解),取该溶液进行连续实验,实验过程如图:下列有关推断不正确的是( )
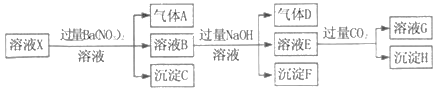
A. 溶液X中一定含有H+、Al3+、NH4+、Fe2+、SO42﹣
B. 根据上述连续实验不能确定溶液X中是否含有Fe3+、Cl﹣
C. 沉淀H为Al(OH)3、BaCO3的混合物
D. 若溶液X为100mL,产生的气体A为44.8mL(标准状况),则X中c(Fe2+)=0.06molL﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一个体积为2 L的密闭容器中,高温下发生反应:Fe(s)+CO2(g) ![]() FeO(s)+CO(g)。其中CO2、CO的物质的量(mol)随时间(min)的变化关系如图所示。
FeO(s)+CO(g)。其中CO2、CO的物质的量(mol)随时间(min)的变化关系如图所示。
(1)反应在1 min时第一次达到平衡状态,固体的质量增加了3.2 g。用CO2的浓度变化表示的反应速率v(CO2)=。
(2)反应进行至2 min时,若只改变温度,曲线发生的变化如图所示,3 min时再次达到平衡,则ΔH0(填“>”“<”或“=”)。
(3)5 min时再充入一定量的CO(g),平衡发生移动。下列说法正确的是(填写编号)。
A.v(正)先增大后减小 B.v(正)先减小后增大
C.v(逆)先增大后减小 D.v(逆)先减小后增大
表示n(CO2)变化的曲线是(填写图中曲线的字母编号)。
(4)请用固态物质的有关物理量来说明该反应已经达到化学平衡状态:。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com