
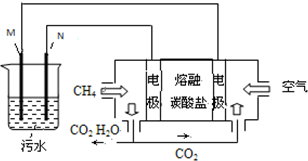
 工业废水中常含有一定量的Cr2O72-,会对人类及生态系统产生很大损害,电解法是一种行之有效的除去铬的方法之一.该法用Fe和石墨作电极电解含Cr2O72-的酸性废水,最终将铬转化为Cr(OH)3沉淀,达到净化目的.某科研小组利用以上方法处理污水,设计了熔融盐电池和污水电解装置如图所示.
工业废水中常含有一定量的Cr2O72-,会对人类及生态系统产生很大损害,电解法是一种行之有效的除去铬的方法之一.该法用Fe和石墨作电极电解含Cr2O72-的酸性废水,最终将铬转化为Cr(OH)3沉淀,达到净化目的.某科研小组利用以上方法处理污水,设计了熔融盐电池和污水电解装置如图所示.分析 (1)实验原理:用Fe为电极进行电解生成Fe2+,作为还原剂还原Cr2O72-,铜离子不具有还原性;
(2)电解池的阳极上发生失电子的氧化反应,根据电极反应产物结合溶液的环境来回答;
(3)燃料电池中,正极发生的反应一定是氧气得电子的过程,据此书写电极反应;
(4)在燃料电池和电解池的串联电路中,转移的电子数目是相同的,据电子守恒进行计算.
解答 解:(1)该实验原理:用Fe为电极进行电解生成Fe2+,作为还原剂还原Cr2O72-,所以金属铁是阳极,不能用Cu电极来代替Fe电极,因阳极产生的Cu2+不能还原Cr2O72-,故答案为:M;不能;因阳极产生的Cu2+不能还原Cr2O72-;
(2)电解池的阳极上发生失电子的氧化反应,阳极附近溶液中,发生反应的离子方程式是:Cr2O72-+6Fe2++14H+═2Cr3++6Fe3++7H2O,根据阳离子移向阴极的原理,则阴极附近的沉淀有Cr(OH)3、Fe(OH)3,故答案为:Cr2O72-+6Fe2++14H+═2Cr3++6Fe3++7H2O;Cr(OH)3、Fe(OH)3;
(3)①料电池中,正极反应一定是氧气的电子的过程,该电池的电解质环境是熔融碳酸盐,所以电极反应为:O2+2CO2+4e-=2CO32- (或2O2+4CO2+8e-=4CO32-),故答案为:O2+2CO2+4e-=2CO32- (或2O2+4CO2+8e-=4CO32-);
(4)阴极的电极反应为:2H++2e-=H2↑,阴极产生了4.48L(标准状况)即2mol的氢气产生,所以转移电子的物质的量为0.4mol,根据电池的负极电极反应是CH4+4CO32--8e-=5CO2+2H2O,当转移0.4mol电子时,消耗CH4(标准状况)的物质的量是0.05mol,其体积V=nVm=0.05mol×22.4L/mol=1.12L,故答案为:1.12L.
点评 本题综合考查了化学平衡原理、氧化还原反应、和电化学知识等内容,考查学生分析和解决问题的能力,难度较大.分析时要根据题给信息,结合相关原理进行解答.


科目:高中化学 来源: 题型:解答题
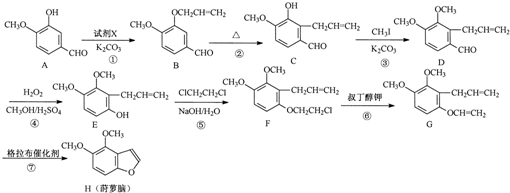
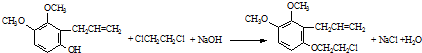 .
.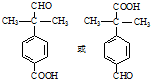 .
.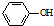 为原料制备
为原料制备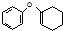 的合成路线流程图(无机试剂任用).合成路线流程图示例如下:CH3CH2Br$→_{△}^{NaOH溶液}$CH3CH2OH$→_{浓硫酸,△}^{CH_{3}COOH}$CH3COOCH2CH3
的合成路线流程图(无机试剂任用).合成路线流程图示例如下:CH3CH2Br$→_{△}^{NaOH溶液}$CH3CH2OH$→_{浓硫酸,△}^{CH_{3}COOH}$CH3COOCH2CH3 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氧化剂 | B. | 还原剂 | C. | 催化剂 | D. | 反应物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分子中键能越大,键长越长,则分子越稳定 | |
| B. | P4和CH4都是正四面体型结构的分子,且键角都为109°28ˊ | |
| C. | 在化学反应中,某元素由化合态变为游离态,则该元素一定被还原 | |
| D. | 电子层结构相同的简单离子,其半径随核电荷数增大而减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | N、P、As的电负性随原子序数的增大而增大 | |
| B. | 价电子排布为4s24p3的元素位于第四周期第ⅤA族,是p区元素 | |
| C. | 2p和3p轨道形状均为纺锤形,能量也相等 | |
| D. | 氮原子的最外层电子的轨道表示式: |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
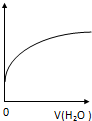
| A. | CH3COO-水解常数 | B. | 溶液中CH3COOH的数目 | ||
| C. | 溶液的PH | D. | 溶液中CH3COO- 的浓度 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X与Y形成化合物时,X可能显负价,也可能显正价 | |
| B. | 第一电离能X可能小于Y | |
| C. | X的最高价含氧酸的酸性强于Y的最高价含氧酸的酸性 | |
| D. | 原子序数X一定大于Y |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com